Líquido Índice Descrición dos líquidos | Características dos líquidos | Notas | Véxase tamén | Menú de navegaciónFísica general.Diccionario de química física.e300015378113261982352ID4017621-6liquidssh85077404005618955505liquido
SólidoLíquidoGasPlasmaSólido amorfoCristalXelVaporNeutroniumPlasma quark-gluonColoideCristal líquido
Estados da materia
materiavolumetemperaturapresióndensidadesólidogasmoléculasanisótropasíndice de refraccióntensión superficialcapilaridadedilátanseflotabilidadeesféricaforzagravidadeprincipio de Pascalpresión hidrostáticadensidadepunto de ebuliciónpunto de conxelaciónsólidosublímansedestilación fraccionadapunto de ebuliciónmoléculasdeformaciónvelocidade de deformaciónviscosidadesólidos viscoelásticosmasa molaraceitespoisescentímetro cuadradoáreavelocidadecmsdinatemperaturagasesviscosímetro
Líquido
Saltar ata a navegación
Saltar á procura

Pinga de auga

Moeda sostida enriba da auga pola tensión superficial
O líquido é un dos catro estados da materia, un líquido é un fluído cuxo volume é constante en condicións de temperatura e presión constante e a súa forma é definida polo recipiente que o contén. É unha substancia que presenta un estado da materia intermedio entre os estados sólido e gasoso.
Un líquido exerce presión no recipiente con igual magnitude cara a tódolos lados. Se un líquido se encontra en repouso, a presión que exerce está dada por:
- p=ρgzdisplaystyle p=rho gz
Onde ρdisplaystyle rho é a densidade do líquido e zdisplaystyle z é a distancia do punto debaixo da superficie.
Índice
1 Descrición dos líquidos
1.1 Líquidos
1.2 Cambios de estado
2 Características dos líquidos
2.1 Viscosidade
2.2 Outras propiedades
3 Notas
4 Véxase tamén
Descrición dos líquidos |
O estado líquido é un estado de agregación da materia intermedio entre o estado sólido e o estado de gas. As moléculas dos líquidos non están tan próximas como as dos sólidos, pero están menos separadas cás dos gases. As moléculas no estado líquido ocupan posicións aleatorias que varían co tempo. As distancias íntermoleculares son constantes dentro dunha marxe estreita. Nalgúns líquidos, as moléculas teñen unha orientación preferente, o que fai que o líquido presente propiedades anisótropas (propiedades, como o índice de refracción, que varían segundo a dirección dentro do material).
Os líquidos presentan tensión superficial e capilaridade, xeralmente dilátanse cando se incrementa a súa temperatura e perden volume cando se arrefrían, aínda que sometidos a compresión o seu volume é moi pouco variable, a diferenza do que acontece con outros fluídos coma os gases. Os obxectos inmersos nalgún líquido están suxeitos a un fenómeno coñecido como flotabilidade.
Líquidos |
A súa forma é esférica se non actúa ningunha forza externa sobre el. Por exemplo, unha pinga de auga en caída libre toma a forma esférica.[1]
Como fluído suxeito á forza da gravidade, a forma dun líquido queda definida polo seu contedor. Nun líquido en repouso suxeito á gravidade en calquera punto do seu seo existe unha presión de igual magnitude cara a todos os lados, como establece o principio de Pascal. Se un líquido se atopa en repouso, a presión hidrostática en calquera punto do mesmo vén dada por:
- p=ρgzdisplaystyle p=rho gz,
Onde ρdisplaystyle rho é a densidade do líquido, gdisplaystyle g é a gravidade (9,8 m/s) e zdisplaystyle z é a distancia do punto considerado á superficie libre do líquido en repouso. Nun fluído en movemento a presión non é necesariamente isótropa porque á presión hidrostática súmase a presión hidrodinámica que depende da velocidade do fluído en cada punto.
Cambios de estado |
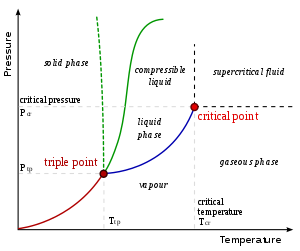
Un diagrama de cambio de fase típico.
En condicións apropiadas de temperatura e presión, a maioría das substancias poden existir en estado líquido. Cando un líquido supera o seu punto de ebulición cambia o seu estado a gaseoso e cando alcanza o seu punto de conxelación cambia a sólido. Porén, algúns sólidos sublímanse ao calentárense, é dicir, pasan directamente do estado sólido ao estado gasoso. A densidade dos líquidos adoita ser algo menor que a densidade da mesma substancia en estado sólido. Algunhas substancias, como a auga, son máis densas en estado líquido.
Por medio da destilación fraccionada, os líquidos poden separarse ao evaporárense cada un ao acadar cadanseu punto de ebulición. A cohesión entre as moléculas dun líquido non é forte abonda polo que as moléculas superficiais poden evaporarse.
Características dos líquidos |
Viscosidade |

Na animación, o fluído de abaixo é máis viscoso có de arriba.
Os líquidos caracterízanse porque as forzas internas do mesmo non dependen da deformación total, aínda que usualmente si dependen da velocidade de deformación; isto é o que diferencia os sólidos sólidos deformables dos líquidos. Os fluídos reais caracterízanse por posuír unha resistencia a fluír chamada viscosidade (que tamén está presente nos sólidos viscoelásticos). Isto significa que na práctica para manter a velocidade nun líquido é preciso aplicar unha forza ou presión, e se esa forza cesa o movemento do fluído cesa tras un tempo.
A viscosidade dun líquido crece ao aumentar a súa masa molar e diminúe o crecer a temperatura. A viscosidade tamén está relacionada coa complexidade das moléculas que constitúen o líquido: é baixa nos gases inertes licuados e alta nos aceites pesados. É unha propiedade característica de todo fluído (líquidos e gases).
A viscosidade é unha medida da resistencia ao desplazamento dun fluído cando existe unha diferenza de presión. Cando un líquido ou un gas flúen suponse a existencia dunha capa estacionaria, de líquido ou gas, adherida sobre a superficie do material a través do que se presenta o fluxo. A segunda capa roza coa adherida superficialmente e esta segunda cunha terceira e así sucesivamente. Este rozamento entre as capas sucesivas é o responsable da oposición ao fluxo, é dicir, o responsable da viscosidade.
A viscosidade mídese en poises, sendo un poise a viscosidade dun líquido no que para esvarar unha capa dun centímetro cuadrado de área á velocidade de 1 cm/s respecto a outra estacionaria situado a 1 cm de distancia fose precisa a forza dunha dina.
A viscosidade adoita decrecer nos líquidos ao aumentar a temperatura, aínda que algúns presentan un aumento de viscosidade cando se quentan. Para os gases a viscosidade aumenta ao aumentar a temperatura.
A viscosidade dun líquido determínase por medio dun viscosímetro entre os que o máis empregado é o de Ostwald.[2] Este emprégase para determinar a viscosidade relativa, é dicir, que coñecendo a viscosidade dun líquido padrón, xeralmente a auga, obtense a viscosidade do líquido problema a partir da ecuación:
‴n1n2=d1×t1d2×t2‴displaystyle '''n_1 over n_2=frac d_1times t_1d_2times t_2'''
Outras propiedades |
- Os líquidos presentan tensión superficial e capilaridade, xeralmente expandense cando se incrementa a súa temperatura e comprimense cando se arrefrían. Os obxectos inmersos nalgún líquido están sometidos a un fenómeno coñecido como flotabilidade.
- As moléculas no estado líquido ocupan posicións ó azar que varían co tempo. As distancias intermoleculares son constantes dentro dunha estreita marxe.
- Cando un líquido supera o seu punto de ebulición cambia o seu estado a gasoso, e cando acada o seu punto de conxelación cambia a sólido.
- Por medio da destilación fraccionada, os líquidos poden separarse entre si ó evaporarse cada un ó atinxir os seus respectivos puntos de ebulición. A cohesión entre as moléculas dun líquido non é o suficientemente forte polo que as moléculas superficiais pódense evaporar.
- As moléculas dos líquidos non están tan próximas como as dos sólidos, pero están menos separadas cás dos gases.
- Nalgúns líquidos, as moléculas teñen unha orientación preferente, o que fai que o líquido presente propiedades anisotrópicas (propiedades, como o índice de refracción, que varían segundo a dirección dentro do material).
- A densidade dos líquidos acostuma ser algo menor que a densidade da mesma substancia en estado sólido. Algunhas substancias, como a auga, son máis densas en estado líquido.
- A presión dun vapor en equilibrio coa súa forma líquida, a chamada presión de vapor, só depende da temperatura; o seu valor a unha temperatura dada é unha propiedade característica de cada líquido. Tamén o son o punto de ebulición, o punto de solidificación e a calor de vaporización (esencialmente, a calor necesaria para transformar en vapor unha determinada cantidade de líquido).
- En certas condicións, un líquido pode quentarse por enriba do seu punto de ebulición; os líquidos nese estado denomínanse superquentados. Tamén é posible arrefriar un líquido por debaixo do seu punto de conxelación.
Notas |
↑ Física general. Escrito por Santiago Burbano de Ercilla, Carlos Gracía Muñoz. (books.google.es). Páxina 295.
↑ Diccionario de química física. Escrito por J M Costa (books.google.es)
Véxase tamén |
Wikimedia Commons ten máis contidos multimedia na categoría: Líquido |
| ||||||||||||||
|
Categoría:
- Estados da materia
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.424","walltime":"0.641","ppvisitednodes":"value":589,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":21126,"limit":2097152,"templateargumentsize":"value":2119,"limit":2097152,"expansiondepth":"value":11,"limit":40,"expensivefunctioncount":"value":10,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":1752,"limit":5000000,"entityaccesscount":"value":11,"limit":400,"timingprofile":["100.00% 517.942 1 -total"," 62.47% 323.579 1 Modelo:Control_de_autoridades"," 13.17% 68.206 1 Modelo:Commonscat"," 12.53% 64.880 1 Modelo:Irmáns"," 11.82% 61.204 1 Modelo:Caixa_lateral"," 7.42% 38.450 1 Modelo:Sen_referencias"," 6.74% 34.921 1 Modelo:Ifsubst"," 6.19% 32.073 1 Modelo:Ambox"," 5.10% 26.395 2 Modelo:Icona_en_título"," 4.70% 24.325 1 Modelo:1000"],"scribunto":"limitreport-timeusage":"value":"0.234","limit":"10.000","limitreport-memusage":"value":3486787,"limit":52428800,"cachereport":"origin":"mw1305","timestamp":"20190413100145","ttl":2592000,"transientcontent":false);mw.config.set("wgBackendResponseTime":131,"wgHostname":"mw1250"););





