Táboa periódica dos elementos Índice Táboa | Métodos de agrupamento | Tendencias periódicas | Historia | Outras táboas periódicas | Cuestións abertas e controversias | Notas | Véxase tamén | Menú de navegacióneeeee0033-454510.1515/pac-2015-0305"New elements on the periodic table are named"Arquivado"Discovery and assignment of elements with atomic numbers 113, 115, 117 and 118"Arquivado"Hello, Nihonium. Scientists Name 4 New Elements On The Periodic Table"Arquivado"Names for elements 113, 115, 117, and 118 finalized by IUPAC""Chemistry: Four elements added to periodic table"Arquivado"Four New Names Officially Added to the Periodic Table of Elements"Arquivado10.1021/ba-1967-0071"New Notations in the Periodic Table"10.1351/pac198860030431Arquivado"The constitution of group 3 of the periodic table"Nomenclature of Inorganic Chemistry: IUPAC Recommendations 20055244558652047235220756597300468713"Electronegativity"1932JAChS..54.2610C10.1021/ja01348a01110.1021/ja00207a003"Electronegativity values from thermochemical data"10.1016/0022-1902(61)80142-52015JOM....67a..87S10.1007/s11837-014-1247-x10.1007/978-94-007-0211-0_13"Measurement of the first ionization potential of lawrencium, element 103"2015Natur.520..209S10.1038/nature143425076682210.1002/jlac.18571040202"Alexandre-Emile Bélguier de Chancourtois (1820–1886)"Arquivado"On Relations Among the Equivalents"Arquivado"On the Law of Octaves"Arquivado10.1086/3499221969JChEd..46..128K10.1021/ed046p1282007NuPhA.789..142Snucl-th/070308610.1016/j.nuclphysa.2007.04.001"D. I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry"Arquivado"Francium (Atomic Number 87), the Last Discovered Natural Element"o orixinal"Detection of Plutonium-244 in Nature"1971Natur.234..132H10.1038/234132a0Arquivado"Deming’s Other 1923 Periodic Table: Mendeleev style""Deming Periodic Table""Adams' Periodic Table"Periodicity:A source book module, version 1.0o orixinal0262-407910.1351/PAC-REP-10-05-01Эксперимент по синтезу 117-го элемента получает продолжение [O experimento na síntese do 117º elemento vai continuar]ArquivadoA Tale of 7 ElementsArquivadoChemistry: An introduction10.1016/0898-1221(86)90167-710.1007/s10698-012-9151-3"All Periodic Tables in the INTERNET Periodic Table Database""The periodic table: Top of the charts"Arquivado"1925 Courtines' Periodic Classification"Arquivado"1949 Wringley's Lamina System"Arquivado"1996 Dufour's Periodic Tree"Arquivado"1989 Physicist's Periodic Table by Timothy Stowe"Arquivado"At last, a definitive periodic table?"10.1002/chemv.201000107Arquivado"2002 Inorganic Chemist's Periodic Table"Arquivado2008JChEd..85..585S10.1021/ed085p58510.4024/43AL09F.jbpc.10.0210.1021/ed084p1145"Table manners"2009NatCh...1...97F2137881010.1038/nchem.183Arquivado"Tres tablas periódicas que explican el irracional consumo de muchos aparatos electrónicos"A New Circular Vision for Electronics"Trouble in the periodic table""IUPAC Periodic Table of the Elements"ArquivadoModeling Marvels: Computational Anticipation of Novel MoleculesArquivado2003JChEd..80..947C10.1021/ed080p9472008JChEd..85.1490S10.1021/ed085p14904435314M"Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3?"Arquivado"The constitution of group 3 of the periodic table"Arquivado1982JChEd..59..634J10.1021/ed059p634"Five ideas in chemical education that must die – part five"Arquivado"Some Comments on the Position of Lawrencium in the Periodic Table"o orixinal2016PCCP...1817351X10.1039/C6CP02706G"transition element"1789962010.1002/anie.2007037102008JChEd..85.1182J10.1021/ed085p1182396300610.2307/39630062011PCCP...13..161P2096737710.1039/c0cp01575j"The continuation of the periodic table up to Z = 172. The chemistry of superheavy elements"10.1007/BF0117201510.1021/ja02218a004"transuranium element (chemical element)"Arquivado2005Natur.433..705C1571694310.1038/nature03336"Would Element 137 Really Spell the End of the Periodic Table? Philip Ball Examines the Evidence"Arquivado10.1021/ed079p60Quantum Physics of Atoms, Molecules, Solids, Nuclei and ParticlesB0000CMCMI10.1119/1.2820395"At Last, A Definitive Periodic Table?"10.1002/chemv.201000107"Is there an optimal periodic table and other bigger questions in the philosophy of science"ArquivadoO nome e o símbolo dos elementos químicosGuía dos elementos químicos. Historia, propiedades e aplicacións7066455M"Periodic Table of Elements""The periodic table of the elements""The Periodic Table of Videos""Táboa periódica dos elementos"eeWorldCat18660559035900XX532419122746941ID4125872-1sh85099885ph1240415452
Táboa periódica dos elementos
Elementos químicos
elementos químicosnúmero atómicoconfiguración electrónicapropiedades químicasbloquesperíodosgruposhalóxenosgases nobresquímicaDmitri Mendeleiev1869predixodescubrindo novos elementoshidróxenooganessonnihoniomoscovioténnessoUnión Internacional de Química Pura e Aplicadareactores nucleares1número atómicoprotónsnúcleoneutrónsisótoposcarbonoperíodocapa electrónicaelectróngruposconfiguración electrónicapropiedades químicasbloque fhidróxenooganessonUnión Internacional de Química Pura e Aplicadanihoniomoscovioténnessoamericioprimitivoseinsteinioástatofranciomecánico cuánticasconfiguración electrónicacapa de valenciametais alcalinosgases nobresnúmeros romanosAméricaEuropagrupo 10IUPACraio atómicoenerxía de ionizaciónelectronegatividadeelectróngrupo 11lantánidosactínidosafinidade electrónicahelio13metaloides312metais de transiciónlantánidosactínidosmetaismetaloidesnon metaiscondutivosaliaxesiónicossalinogases nobresmetais alcalinosmetais alcalinotérreoslantánidosactínidosmetais de transiciónmetais de postransiciónnon metais poliatómicosnon metais diatómicosgases nobresmetais refractariosmetais nobrescapas electrónicasnúmero atómicoregra de Madelungneonperíodohidróxenometais alcalinosraio atómicoenerxía de ionizaciónafinidade electrónicaJohann Wolfgang DöbereinerNiels Bohrteoría cuánticacerioiterbiolantánidoshafniocirconiotántaloniobiocontracción lantánidaplatinoefecto relativistaefecto de par inertemagnesioátomoelectrónsnúmero atómicoelectróns de valenciaLinus Paulingflúorcesiogalioxermanioaluminiosilicioelementos do período 4chumbotaliobismutoiónnon metaismetaisclorogrupo 17grupo 1halóxenoshidróxenoalcalinoselementos do grupo 11alcalinotérreosnitróxenofósforomanganesoreniogrupo 1efectos relativistascesiofrancioosíxenoflúorclorometaloideselementos do grupo 3escandioitriolantanoactiniometais alcalinotérreosluteciolaurenciolantánidogrupo 11cobreprataourogrupo 12cinccadmiomercuriogrupo 13gases nobreshalóxenosmetais alcalinosAntoine Lavoisierelementos químicosgasesmetaisnon metaisterrasJohann Wolfgang Döbereinerlitiosodiopotasioreactivoslei dos tríosLeopold GmelinJean-Baptiste DumasAugust KekulécarbonometanohidróxenovalenciaAlexandre-Emile Béguyer de ChancourtoisiónscompostosMendeleievJulius Lothar MeyerWilliam OdlingJohn Newlandsoitavasmúsicalei das oitavasChemical SocietyxermanioGustavus HinrichsDmitri MendeleievJulius Lothar Meyergalioxermaniopesos atómicostelurioiodofamilias químicasHenry Moseleynúmero atómicoprotónsneutrónsaluminioouroestado de oxidaciónfrancioplutonioProxecto Manhattanconfiguracións electrónicasmecánica cuánticacapa cuánticaGlenn T. Seaborgactínidoslantánidospremio Nobel de Químicaelementos transuránicosneptuniodecaencontroversiasDubnaRusiaténnessonihoniomoscoviooganessonbloques da táboa periódicaWilliam B. JensencírculocúbicascilíndricasespirallemniscastaprismaspirámideesféricastriangularesTheodor BenfeyGiguèreEric ScerriCharles Janetmecánica cuánticacondutividade eléctricatérmica2019Foro Económico Mundialreciclaxeconfiguracións electrónicashidróxenoheliolitioberiliogases nobresneonIUPACargonalcalinoscarbonopotencial de ionizaciónafinidade electrónicaelectronegatividadegrupo 14elemento do período 1escandioitrioelementos do grupo 3lantanoactinioluteciolaurenciolantánidosBohuslav Braunercirconioasteroidessistema solarMendeleievNiels BohrGlenn T. SeaborgitrioIUPAClantanoactiniogrupo 3anos 1940cesiobarioescandioitrioiterbiolutecioespectroscópicosgadoliniopunto de fusiónelectronegatividaderaio iónicoiónsluteciolaurencioescandioitrioanos 19201930anos 19501960nihoniolantánidosactínidositrioIUPACmetal de transicióncatiónselementos do grupo 12cinccadmiomercuriofluoruro de mercurio (VI)elementos do grupo 3oganessonhassiocopernicionihonioflerovioefectos relativistasfleroviogases nobresgrupo do carbonochumboperíodo 8Seaborg119120Pekka Pyykköregra de Madelungilla de estabilidadeelemento 126liñas de goteoJohn EmsleyRichard Feynmanmodelo de Bohrvelocidade da luzecuación relativista de Diracparadoxo de Kleinbaleiroemisión espontánea dun positrónEric Scerri
Táboa periódica dos elementos
Saltar ata a navegación
Saltar á procura

A táboa periódica dos elementos é unha disposición en formato de táboa dos elementos químicos, ordenados polo seu número atómico, configuración electrónica e propiedades químicas recorrentes. Esta ordenación presenta unhas tendencias periódicas, como por exemplo a presenza de elementos semellantes na mesma columna. Presenta tamén catro bloques con propiedades químicas semellantes. As filas da táboa denomínanse períodos, mentres que as columnas chámanse grupos. Seis destes grupos teñen nomes xeralmente aceptados ademais de números; por exemplo, os elementos do grupo 17 son os halóxenos e os do grupo 18 os gases nobres. A táboa periódica pode utilizarse para derivar relacións entre as propiedades dos elementos e predicir as propiedades de novos elementos aínda non descubertos ou obtidos de maneira sintética. A táboa fornece un marco de traballo útil para a análise dos comportamentos químicos, e o seu uso é estendido dentro da química e outras ciencias.
O químico ruso Dmitri Mendeleiev publicou a primeira táboa periódica notable no ano 1869. Mendeleiev desenvolveu esta táboa para ilustrar tendencias periódicas nas propiedades dos elementos que se coñecían ata entón. Tamén predixo algunhas propiedades de elementos aínda non coñecidos naquel entón que encherían os ocos na súa táboa, e a maioría destas predicións resultaron ser correctas cando se descubriron posteriormente os elementos en cuestión. A táboa periódica de Mendeleiev foise expandindo e refinando a medida que se foron descubrindo novos elementos e se desenvolveron novos modelos teóricos para explicar os comportamentos químicos.
Tódolos elementos dende o número atómico 1 (hidróxeno) ata o 118 (oganesson) foron descubertos ou obtidos sinteticamente, os últimos catro deles (nihonio, moscovio, ténnesso e oganesson) confirmados pola Unión Internacional de Química Pura e Aplicada (IUPAC) no ano 2015 e nomeados oficialmente en 2016, completándose con estes as primeiras sete filas da táboa periódica. Os primeiros 94 elementos existen de forma natural, malia que algúns deles só se atopan en cantidades moi pequenas de forma natural e foron obtidos de maneira sintética en laboratorios antes de ser descubertos na natureza. Os elementos de número atómico dende o 95 ata o 118 só foron obtidos sinteticamente en laboratorios ou reactores nucleares.
Índice
1 Táboa
2 Métodos de agrupamento
2.1 Grupos
2.2 Períodos
2.3 Bloques
2.4 Metais, metaloides e non metais
3 Tendencias periódicas
3.1 Raio atómico
3.2 Enerxía de ionización
3.3 Electronegatividade
3.4 Afinidade electrónica
3.5 Carácter metálico
3.6 Grupos ponte
4 Historia
4.1 Primeiros intentos de sistematización
4.2 Táboa de Mendeleiev
4.3 Segunda versión e desenvolvemento posterior
5 Outras táboas periódicas
5.1 Táboa de 32 columnas
5.2 Táboas con estruturas diferentes
5.3 Táboas aplicadas noutros ámbitos
6 Cuestións abertas e controversias
6.1 Situación do hidróxeno e do helio
6.2 Elementos do grupo 3 nos períodos 6 e 7
6.2.1 Lantano e actinio
6.2.2 Lutecio e laurencio
6.2.3 Lantánidos e actínidos
6.3 Grupos incluídos nos metais de transición
6.4 Elementos con propiedades químicas descoñecidas
6.5 Extensións adicionais da táboa periódica
6.6 Elemento co maior número atómico posible
6.7 Formato óptimo
7 Notas
8 Véxase tamén
8.1 Bibliografía
8.2 Ligazóns externas
Táboa |
Táboa periódica | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Grupo → | 1 | 2 | 3 | | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
| Metais alcalinos | Metais alcalinotérreos | Nitroxenoides | Calcóxenos | Halóxenos | Gases nobres | ||||||||||||||||||||||||||||
↓ Período 1 | |||||||||||||||||||||||||||||||||
2 | |||||||||||||||||||||||||||||||||
3 | |||||||||||||||||||||||||||||||||
4 | |||||||||||||||||||||||||||||||||
5 | |||||||||||||||||||||||||||||||||
6 | |||||||||||||||||||||||||||||||||
7 | |||||||||||||||||||||||||||||||||
| | |||||||||||||||||||||||||||||||||
| | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Cada elemento químico ten un número atómico único (Z) que representa o número de protóns no seu núcleo. A maioría de elementos teñen números de neutróns diferenciados entre distintos átomos, recibindo estas variantes o nome de isótopos. Por exemplo, o carbono ten tres isótopos de ocorrencia natural: tódolos seus átomos teñen seis protóns e a maioría teñen seis neutróns tamén, pero ó redor do 1% ten sete neutróns, e unha fracción moi pequena ten oito neutróns.[1] Os isótopos nunca se indican de forma separada na táboa periódica, senón agrupados baixo un único elemento. Os elementos sen isótopos estables presentan a masa atómica dos seus isótopos máis estables entre parénteses.[2]
Na táboa periódica estándar os elementos lístanse en orde crecente de número atómico. Comézase unha nova fila (período) cando unha nova capa electrónica ten o seu primeiro electrón. As columnas (grupos) determínanse pola configuración electrónica do átomo, polo que os elementos co mesmo número de electróns nunha subcapa particular entran dentro da mesma columna. Os elementos con propiedades químicas semellantes adoitan entrar no mesmo grupo da táboa periódica, malia que no bloque f, e en certa medida no bloque d, os elementos do mesmo período tenden a ter propiedades semellantes tamén. Por mor disto, resulta relativamente sinxelo predicir as propiedades químicas de un elemento coñecendo as propiedades dos elementos do seu arredor.[3]
A data de 2017 a táboa periódica tiña 118 elementos confirmados, dende o elemento 1 (hidróxeno) ata o 118 (oganesson). Os elementos 113, 115, 117 e 118, os de descubrimento máis recente, foron confirmados oficialmente pola Unión Internacional de Química Pura e Aplicada (IUPAC) en decembro de 2015. A IUPAC anunciou os nomes e símbolos propostos para estes elementos, nihonio (Nh), moscovio (Mc), ténnesso (Ts) e oganesson (Og), en xuño de 2016 e fixéronse oficiais en novembro de 2016,[4][5][6] completándose con estes as primeiras sete filas da táboa periódica.[7][8][9]
Os primeiros 94 elementos danse de forma natural, mentres que os 24 restantes, dende o americio ata o oganesson (95–118) so poden obterse sinteticamente en laboratorios. Dos 94 elementos de ocorrencia natural, 83 son primitivos e 11 danse só en cadeas de decaemento doutros elementos primitivos.[10] Non se observou nunca ningún elemento máis pesado que o einsteinio (elemento 99) en cantidades macroscópicas na súa forma pura, sucedendo o mesmo para o ástato (elemento 85). O francio (elemento 87) só foi fotografado en forma de luz emitida dende cantidades microscópicas.[11]
Métodos de agrupamento |
Grupos |
- Artigo principal: Grupo da táboa periódica.
Un grupo ou familia da táboa periódica é cada unha das columnas verticais da táboa. Os grupos adoitan ter tendencias periódicas máis significativas que os períodos e os bloques. As teorías mecánico cuánticas modernas sobre a estrutura atómica explican as tendencias dos grupos propoñendo que os elementos dentro do mesmo grupo xeralmente teñen a mesma configuración electrónica na súa capa de valencia.[12] Consecuentemente, os elementos do mesmo grupo tenden a ter unha química compartida e exhiben unha clara tendencia nas propiedades cun número atómico crecente.[13] Porén, nalgunhas partes da táboa periódica como o bloque d e o bloque f, as semellanzas horizontais poden ser tan importantes ou incluso máis pronunciadas que as semellanzas verticais.[14][15][16]
Seguindo a convención internacional de nomes, os grupos numéranse dende o 1 ata o 18 dende a columna máis á esquerda (os metais alcalinos) ata a columna máis á dereita (os gases nobres).[17] Previamente os grupos indicábanse con números romanos. En América, os números romanos ían seguidos dunha "A" se o grupo estaba no bloque s ou p, ou dunha "B" se o grupo estaba no bloque d. Os números romanos utilizados corresponden co último díxito da convención de nomes actual. En Europa as letras eran semellantes, pero a "A" utilizábase se o grupo estaba antes do grupo 10 e a "B" para este grupo e os seguintes. A maiores, os grupos 8, 9 e 10 adoitaban tratarse coma un grupo triplo, coñecido de forma colectiva en ámbalas dúas notacións como o grupo VIII. En 1988 entrou en vigor o novo sistema de nomeamento da IUPAC, desbotando os nomes anteriores.[18] Algúns destes grupos recibiron nomes triviais non sistemáticos, malia que algúns destes nomes non son de uso habitual. Os grupos do 3 ó 10 non teñen nomes triviais e noméanse simplemente polo seu número de grupo ou polo nome do primeiro membro do grupo, xa que estes teñen poucas semellanzas e tendencias verticais.[17]
Os elementos dun mesmo grupo tenden a seguir uns padróns de raio atómico, enerxía de ionización e electronegatividade. De arriba a abaixo nun grupo, os raios atómicos dos elementos aumentan, e xa que van tendo progresivamente máis niveis de enerxía cheos, os seus electróns de valencia atópanse máis lonxe do núcleo progresivamente. Dende a parte superior, cada elemento sucesivo ten unha menor enerxía de ionización xa que vai resultando máis doado eliminar un electrón, xa que os átomos presentan unha unión cada vez menor. De forma semellante, os grupos presentan unha diminución da electronegatividade de arriba a abaixo por mor da cada vez maior distancia entre os electróns de valencia e os núcleos.[19] Porén, existen excepcións a estas tendencias. Por exemplo, no grupo 11, a electronegatividade increméntase nos elementos inferiores do grupo.[20]
Grupos da táboa periódica | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Grupo IUPAC | 1 | 2 | 3a | a | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
Mendeleiev (I–VIII) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIB | IVB | VB | VIB | VIIB | b | ||||
CAS (EUA, A-B-A) | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA | ||||
Antigo IUPAC (Europa, A-B) | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIB | IB | IIB | IIIB | IVB | VB | VIB | VIIB | 0 | ||||
| Nome trivial | Metais alcalinos | Metais alcalinotérreosr | Metais de cuñaxe | Metais volátiles | Icoxasenos | Cristalóxenos | Nitroxenoidesr | Calcóxenosr | Halóxenosr | Gases nobresr | ||||||||||
| Nome por elementor | Grupo do litio | Grupo do berilio | Grupo do escandio | Grupo do titanio | Grupo do vanadio | Grupo do cromo | Grupo do manganes | Grupo do ferro | Grupo do cobalto | Grupo do níquel | Grupo do cobre | Grupo do cinc | Grupo do boro | Grupo do carbono | Grupo do nitróxeno | Grupo do osíxeno | Grupo do flúor | Grupo do helio ou neon | ||
Período 1 | h H h | He | ||||||||||||||||||
Período 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||
Período 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||
Período 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||
Período 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
Período 6 | Cs | Ba | La | Ce–Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
Período 7 | Fr | Ra | Ac | Th–Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
a O grupo 3 inclúe o escandio (Sc) e o itrio (Y). Para o resto do grupo, as fontes diferencian entre (1) lutecio (Lu) e laurencio (Lr), ou (2) lantano (La) e actinio (Ac), ou (3) o conxunto completo de 15+15 lantánidos e actínidos. A IUPAC comezou a finais de 2015 un proxecto para estandarizar a definición ben como (1) "Sc, Y, Lu e Lr", ou (2) "Sc, Y, La e Ac".[21] | ||||||||||||||||||||
b O grupo 18, os gases nobres, non foran descubertos cando Mendeleiev publicou a súa táboa orixinal. Posteriormente en 1902 Mendeleiev aceptou as evidencias da súa existencia indicando que poderían situarse nun novo "grupo 0", mantendo a consistencia e sen rachar o principio da táboa periódica.[22][23] | ||||||||||||||||||||
r Nome do grupo segundo recomenda a IUPAC.[24] | ||||||||||||||||||||
h O hidróxeno (H), malia situarse no grupo 1, non se considera parte dos metais alcalinos.[25] | ||||||||||||||||||||
Períodos |
- Artigo principal: Período da táboa periódica.
Os períodos son as filas horizontais da táboa periódica. Malia que os grupos adoitan ter tendencias periódicas máis significativas, hai rexións nas que as tendencias horizontais son máis significativas, como por exemplo no bloque f, onde os lantánidos e actínidos forman dúas series horizontais substanciais de elementos.[26] Os elementos do mesmo período presentan tendencias no raio atómico, enerxía de ionización, afinidade electrónica e electronegatividade. Ó desprazarse de esquerda a dereita por un período, o radio atómico adoita diminuír. Isto sucede porque cada elemento sucesivo ten un protón e un electrón engadido, o que provoca que o electrón sufra unha maior atracción cara o núcleo.[27] Esta diminución no raio atómico tamén provoca un incremento na enerxía de ionización ó desprazarse de esquerda a dereita polo período. Canto máis firmemente unido está un elemento, máis enerxía se precisa para eliminar un electrón. A electronegatividade incrementa da mesma forma que a enerxía de ionización por mor da atracción exercida polo núcleo nos electróns.[19] A afinidade electrónica tamén presenta unha lixeira tendencia nos períodos. Os metais (na parte esquerda) adoitan ter unha menor afinidade electrónica que os non metais (na parte dereita), coa excepción dos gases nobres.[28]
Bloques |
- Artigo principal: Bloque da táboa periódica.
Varias rexións específicas da táboa periódica denomínanse bloques, facendo referencia á secuencia na que se enchen as capas de electróns dos elementos. Cada un dos bloques noméase segundo a subcapa na que se atopa o considerado como último electrón.[29][a] O bloque s comprende os dous primeiros grupos (metais alcalinos e alcalinotérreos) ademais do hidróxeno e do helio. O bloque p comprende os últimos seis grupos, do 13 ó 18, e contén entre outros elementos tódolos metaloides. O bloque d comprende os grupos do 3 ó 12 e contén tódolos metais de transición. O bloque f, representado habitualmente por debaixo do resto da táboa periódica, non ten ningún número de grupos e comprende os lantánidos e os actínidos.[32]
Bloques da táboa periódica | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
| ↓ Período | ||||||||||||||||||||||||||||||||
1 | 1 H | 2 He | ||||||||||||||||||||||||||||||
2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||||||||||||||||
3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||||||||||||||
4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | ||||||||||||||
5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | ||||||||||||||
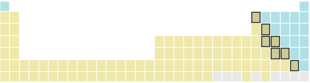
6 | 55 Cs | 56 Ba | 57 La | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | ||||||||||||||
7 | 87 Fr | 88 Ra | 89 Ac | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Nh | 114 Fl | 115 Mc | 116 Lv | 117 Ts | 118 Og | ||||||||||||||
| 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | |||||||||||||||||||
| 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | |||||||||||||||||||
| ||||||||||||||||||||||||||||||||
Metais, metaloides e non metais |
Metais Metaloides Non metais Propiedades químicas descoñecidas
De acordo ás súas propiedades físicas e químicas comúns, os elementos poden clasificarse en tres categorías principais: metais, metaloides e non metais. Os metais adoitan ser sólidos brillantes moi condutivos que forman aliaxes os uns cos outros e compostos iónicos de tipo salino cos non metais (agás cos gases nobres). A maioría dos non metais son gases illantes con ou sen cor, e os non metais que forman compostos con outros non metais presentan ligazóns covalentes. Entre os metais e os non metais están os metaloides, que presentan propiedades intermedias ou mixtas.[33]
Os metais e non metais poden clasificarse adicionalmente en subcategorías que presentan unha gradación de propiedades dende metálicas a non metálicas ó desprazarse de esquerda a dereita polas filas. Os metais subdivídense nos altamente reactivos metais alcalinos, os menos reactivos metais alcalinotérreos, os lantánidos e actínidos, os metais de transición arquetípicos e finalmente os física e quimicamente débiles metais de postransición. Os non metais divídense simplemente nos non metais poliatómicos, que sendo os máis próximos ós metaloides presentan algunhas características metálicas incipientes, nos non metais diatómicos que son esencialmente non metálicos, e os gases nobres monoatómicos, que son non metálicos e case completamente inertes. Tamén existen e noméanse en ocasións outros subgrupos especializados, como poden ser por exemplo os metais refractarios ou os metais nobres, ámbolos dous subgrupos neste caso dos metais de transición.[34][35]
Tendencias periódicas |
- Véxase tamén: Configuración electrónica.

Tendencias da táboa periódica. O sentido de cada frecha indica un incremento.
A configuración electrónica ou organización dos electróns que orbitan os átomos neutrais presenta un padrón ou periodicidade recorrente. Os electróns ocupan unha serie de capas electrónicas, e cada unha destas está composta por unha ou máis subcapas (nomeadas s, p, d, f e g). Segundo aumenta o número atómico os electróns enchen estas capas e subcapas de forma progresiva seguindo de forma aproximada a regra de Madelung ou regra de ordenación da enerxía. Por exemplo, a configuración electrónica do neon é 1s2 2s2 2p6. Cun número atómico de 10, o neon ten dous electróns na primeira capa, e oito electróns na segunda—dous destes na subcapa s e seis na subcapa p. En termos da táboa periódica, a primeira ocorrencia dun electrón ocupando unha nova capa correspóndese co comezo dun novo período, ocupando estas posicións o hidróxeno e os metais alcalinos.[36][37]
Xa que as propiedades dun elemento están determinadas principalmente pola súa configuración electrónica, as propiedades dos elementos na táboa presentan padróns recorrentes ou comportamentos periódicos relacionados co seu raio atómico, enerxía de ionización e afinidade electrónica. Esta periodicidade de propiedades, detectadas por Johann Wolfgang Döbereiner tempo antes de que Niels Bohr desenvolvera a teoría subxacente, deron lugar ó establecemento das leis periódicas (as propiedades dos elementos que recorren en diferentes intervalos) e á formulación das primeiras táboas periódicas.[36][37]
Raio atómico |
- Artigo principal: Raio atómico.

Relación do número atómico co raio atómico.[b]
O raio atómico varía de forma previsible na táboa periódica. Os raios atómicos xeralmente diminúen ó desprazarse por cada un dos períodos da táboa, dende os alcalinos ata os gases nobres, e increméntanse ó baixar de grupo. Os radios aumentan de forma pronunciada entre os gases nobres ó final de cada período e o metal alcalino que comeza o seguinte período. Estas tendencias dos raios atómicos explícanse pola teoría de capas electrónicas do átomo, e forneceron probas importantes para o desenvolvemento e confirmación da teoría cuántica.[38]
Os electróns da subcapa 4f, que se enche progresivamente dende o cerio (elemento 58) ata o iterbio (elemento 70), non son particularmente efectivos na protección da carga nuclear en aumento procedente das subcapas máis exteriores. Os elementos inmediatamente seguintes ós lantánidos teñen raios atómicos máis pequenos do agardado, e son case idénticos ós raios atómicos dos elementos que se sitúan encima deles.[39] Como exemplos disto, o hafnio ten virtualmente o mesmo raio atómico e propiedades químicas que o circonio, e o tántalo ten un raio atómico semellante ó niobio. Isto coñécese como a contracción lantánida. O efecto desta contracción é notable ata chegar ó platino (elemento 78), e a partir deste enmascárase polo efecto relativista coñecido como efecto de par inerte.[40] A contracción do bloque d, un efecto semellante entre o bloque d e o bloque p, é menos pronunciada que a contracción lantánida pero prodúcese por mor dunha causa semellante.[39]
Enerxía de ionización |
- Artigo principal: Enerxía de ionización.

Primeira enerxía de ionización. Cada período comeza nun mínimo para os alcalinos e finaliza nun máximo para os gases nobres
Para un átomo determinado, as enerxías de ionización sucesivas increméntanse co grao de ionización. Tomando o magnesio como exemplo, a primeira enerxía de ionización é de 738 kJ/mol e a segunda de 1450 kJ/mol. Os electróns nos orbitais máis próximos experimentan forzas de atracción electrostática máis grandes, polo que a súa eliminación precisa dunha enerxía cada vez maior. A enerxía de ionización aumenta segundo se avanza cara arriba e cara a dereita pola táboa periódica.[40]
Danse grandes saltos nas enerxías de ionización molar sucesivas cando se elimina un electrón dunha configuración de gas nobre (capa electrónica completa). Tomando de novo o magnesio como exemplo, as primeiras dúas enerxías de ionización molar deste elemento correspóndense á eliminación de dous electróns da subcapa 3s, mentres que a terceira enerxía de ionización aumenta ata os 7730 kJ/mol para a eliminación dun electrón da subcapa 2p da configuración moi estable de Mg2+. Saltos semellantes aparecen tamén nas enerxías de ionización doutros átomos da terceira fila da táboa.[40]
Electronegatividade |
- Artigo principal: Electronegatividade.

Variación da electronegatividade segundo o grupo e período
A electronegatividade é a tendencia dun átomo a atraer electróns.[41] A electronegatividade dun átomo vese afectada tanto polo seu número atómico coma pola distancia entre os electróns de valencia e o núcleo. A maior electronegatividade, maior atracción de electróns. Este concepto propúxoo por primeira vez Linus Pauling en 1932.[42] Polo xeral, a electronegatividade increméntase ó desprazarse de esquerda a dereita por un período, e diminúe en sentido descendente nos grupos. O flúor é o elemento máis electronegativo[c] e o cesio o menos electronegativo de entre os elementos dos que se teñen datos substanciais.[20]
Existen algunhas excepcións de esta regra xeral. O galio e o xermanio teñen unha electronegatividade maior que o aluminio e o silicio respectivamente por mor da contracción do bloque d. Os elementos do período 4 inmediatamente posteriores á primeira fila dos metais de transición teñen raios atómicos infrecuentemente pequenos xa que os electróns da subcapa 3d non son efectivos á hora de protexer da carga nuclear en aumento, e o menor tamaño atómico presenta unha correlación cunha maior electronegatividade.[20] A anómala alta electronegatividade do chumbo, particularmente cando se compara co talio e o bismuto, semella ser produto da selección e dispoñibilidade dos datos, xa que outros métodos de cálculo distintos ó de Pauling indican tendencias periódicas normais para estes elementos.[44]
Afinidade electrónica |
- Artigo principal: Afinidade electrónica.

Dependencia da afinidade electrónica co número atómico.[45]
A afinidade electrónica dun átomo é a cantidade de enerxía liberada cando se engade un electrón a un átomo neutral para formar un ión negativo. Malia que esta afinidade electrónica varía en gran medida, danse certos padróns nos elementos. De forma xeral, os non metais teñen valores de afinidade electrónica máis positivos que os metais. O cloro é o elemento que atrae un electrón extra coa maior forza, e as afinidades electrónicas dos gases nobres non foron medidas de forma conclusiva.[46]
A afinidade electrónica xeralmente aumenta ó desprazarse por un período, provocado polo feito de que as capas de valencia dos átomos vanse enchendo. Un átomo do grupo 17 libera máis enerxía que un átomo do grupo 1 ó gañar un electrón xa que obtén unha capa de valencia baleira e polo tanto é máis estable.[46] Os valores da afinidade electrónica increméntanse ó desprazarse por cada período, culminando nos halóxenos antes de precipitarse cos gases nobres. Hai picos de valores localizados no hidróxeno, nos alcalinos e nos elementos do grupo 11, provocados por unha tendencia a completar a capa s. Outros exemplos de pasos localizados como os dos alcalinotérreos, nitróxeno, fósforo, manganeso e renio están provocados por capas s cheas ou capas d ou p medio cheas.[47]
Ó desprazarse cara abaixo nun grupo o resultado agardado sería unha tendencia de afinidade electrónica en diminución, xa que o electrón adicional entraría nun orbital máis afastado do núcleo, e polo tanto sufriría unha atracción menor e liberaría menos enerxía cando se engade. Porén, ó desprazarse cara abaixo nun grupo, ó redor dun terzo dos elementos son anómalos, cos elementos máis pesados presentando unha maior afinidade electrónica que os contiguos máis lixeiros. Isto débese en gran medida á pobre protección dos electróns nas capas d e f. A diminución uniforme na afinidade electrónica só aplica no caso dos átomos do grupo 1.[45][48]
Carácter metálico |
A menor valor de enerxía de ionización, electronegatividade e afinidade electrónica, maior carácter metálico presenta o elemento. De forma inversa, o carácter non metálico increméntase cando diminúen os valores destas propiedades.[49] Dadas as tendencias periódicas destas tres propiedades, o carácter metálico tende a diminuír ó desprazarse por un período ou fila, e con algunhas regularidades debidas á pobre protección dos electróns da capa d e f e a efectos relativistas,[50] tende a incrementarse ó desprazarse cara a abaixo por un grupo ou columna. Por isto, os elementos máis metálicos, como por exemplo o cesio ou o francio, atópanse na parte inferior da táboa periódica tradicional, e os elementos máis non metálicos, como por exemplo o osíxeno, flúor ou cloro, sitúanse na parte superior dereita. A combinación de tendencias horizontais e verticais no carácter metálico serve de explicación para a liña divisoria entre os metais e non metais en forma de escaleira presente na táboa, e a práctica de incluír a varios elementos adxacentes a esa liña ou adxacentes a estes outros dentro da categoría dos metaloides.[51][52]
Grupos ponte |
De esquerda a dereita nos catro bloques da táboa periódica en forma de 32 columnas atópanse unha serie de grupos ponte de elementos, localizados aproximadamente entre cada un dos bloques.[53] Estes grupos, ó igual que os metaloides, presentan propiedades intermedias ou mixtas dos dous grupos lindeiros. Quimicamente os elementos do grupo 3, escandio, itrio, lantano e actinio compórtanse en gran medida como os metais alcalinotérreos[54] ou de forma máis xeral como os metais do bloque s,[55][56] pero teñen algunhas das propiedades físicas dos metais de transición do bloque d.[57] O lutecio e o laurencio, situados ó final do bloque f, poden constituír outro grupo ponte. O lutecio comportase quimicamente como un lantánido pero presenta unha mestura de propiedades físicas dos lantánidos e dos metais de transición.[58][59] O laurencio, como análogo do lutecio, teoricamente presentaría características semellantes a este.[60][61][d] Os metais de cuñaxe no grupo 11 (cobre, prata e ouro) son quimicamente capaces de actuar ben como metais de transición ou ben como metais do grupo principal.[62] Os metais volátiles do grupo 12 (cinc, cadmio, e mercurio) están considerados en ocasións como ponte entre o bloque d e o bloque p. Teoricamente son elementos do bloque d mais presentan algunhas propiedades dos metais de transición e aseméllanse máis os elementos veciños do grupo 13.[63][64] Pola súa banda, os relativamente inertes gases nobres do grupo 18 fan de ponte entre os grupos de elementos máis reactivos da táboa periódica, os halóxenos do grupo 17 e os metais alcalinos do grupo 1.[53]
Historia |
Primeiros intentos de sistematización |

O descubrimento dos elementos aplicado a datas significativas do desenvolvemento da táboa periódica
En 1789 Antoine Lavoisier publicou unha lista de 33 elementos químicos, agrupándoos en gases, metais, non metais e terras.[65] Os químicos pasaron o século seguinte procurando un esquema de clasificación máis preciso. En 1829 Johann Wolfgang Döbereiner observou que a maioría dos elementos podían agruparse en tríos baseándose nas súas propiedades químicas. Por exemplo o litio, o sodio e o potasio podían agruparse xuntos nun trío como metais brandos reactivos. Döbereiner tamén observou que, ó dispoñelos por peso atómico, o segundo membro de cada trío era aproximadamente a media do primeiro e do terceiro.[66] Isto pasou a coñecerse como a lei dos tríos.[67] O químico alemán Leopold Gmelin traballou con este sistema, e no ano 1843 tiña identificado dez tríos, tres grupos de catro elementos e un grupo de cinco. Pola súa banda, Jean-Baptiste Dumas publicou unha obra en 1857 na que describía as relacións entre varios grupos de metais. Malia que varios químicos foron capaces de identificar relacións entre pequenos grupos de elementos, aínda non se desenvolvera un esquema que os englobase a todos.[66]
En 1857 o químico alemán August Kekulé observou que o carbono adoitaba ter outros catro átomos unido a el, indicando que o metano por exemplo ten un átomo de carbono e catro átomos de hidróxeno.[68] Este concepto pasou a coñecerse eventualmente como valencia, indicando que os distintos elementos poden ligar cun número distinto de átomos.[69]
En 1862 o xeólogo francés Alexandre-Emile Béguyer de Chancourtois publicou unha versión temperá de táboa periódica, que denominou "hélice telúrica", converténdose no primeiro en indicar a periodicidade dos elementos. Cos elementos dispostos nunha espiral sobre un cilindro ordenados por peso atómico crecente, Chancourtois demostrou que os elementos con propiedades semellantes adoitaban darse en intervalos regulares. A súa táboa incluía algúns ións e compostos a maiores dos propios elementos. O seu texto tamén usaba termos xeolóxicos no lugar de químicos, e non incluía un diagrama. Como resultado disto, non obtivo case ningunha atención ata a publicación dos traballos de Mendeleiev.[70]
En 1864 o químico alemán Julius Lothar Meyer publicou unha táboa con 44 elementos dispostos por valencia. Esta táboa indicaba que os elementos con propiedades semellantes adoitaban compartir a mesma valencia.[71] De forma concorrente, o químico inglés William Odling publicou unha disposición de 57 elementos, ordenados en base ós seus pesos atómicos. Con algunhas irregularidades e baleiros, Odling indicou o que semellaba ser unha periodicidade de pesos atómicos entre os elementos.[72] Odling aludiu á idea dunha lei periódica pero non continuou investigándoa.[73] Posteriormente en 1870 propuxo unha clasificación baseada nas valencias dos elementos.[74]

Táboa periódica de Newlands presentada á Chemical Society en 1866, baseada na lei das oitavas
O químico inglés John Newlands produciu unha serie de artigos dende 1863 ata 1866 indicando que cando os elementos se listaban en orde de peso atómico crecente, aparecían propiedades físicas e químicas recorrentes en intervalos de oito, comparando esta periodicidade as oitavas da música.[75][76] Esta denominada lei das oitavas foi ridiculizada polos coetáneos de Newlands, e a Chemical Society rexeitou publicar os seus traballos.[77] Porén, Newlands foi capaz de bosquexar unha táboa de elementos e utilizouna para predicir a existencia de elementos aínda non descubertos, como por exemplo o xermanio.[78] A Chemical Society non admitiu a importancia dos seus descubrimentos ata cinco anos despois de acreditar a Mendeleiev.[79]
En 1867 Gustavus Hinrichs, químico de orixe danesa asentado nos Estados Unidos, publicou un sistema periódico en espiral baseado no espectro e pesos atómicos e nas semellanzas químicas. Este traballo considerouse idiosincrático, ostentoso e labiríntico, o que provocou que obtivese pouco recoñecemento e aceptación.[80][81]
Táboa de Mendeleiev |

Unha versión da táboa periódica de Mendeleiev de 1869, cos períodos dispostos en vertical e os grupos en horizontal.
O químico ruso Dmitri Mendeleiev e o químico alemán Julius Lothar Meyer publicaron de forma independente as súas táboas periódicas en 1869 e 1870 respectivamente.[82] A táboa de Mendeleiev era a súa primeira versión publicada, mentres que a de Meyer era unha versión ampliada da súa propia táboa de 1864.[83] Ámbolos dous construíron as súas táboas listando os elementos en filas ou columnas por orde de peso atómico e comezando unha nova fila ou columna cando as características dos elementos comezaban a repetirse.[84]
O recoñecemento e aceptación que se lle deu a táboa de Mendeleiev baseouse en dúas das súas decisións. A primeira delas foi deixar ocos na táboa onde semellaba que o elemento correspondente aínda non se descubrira.[85] Mendeleiev non foi o primeiro químico en facer isto, pero foi o primeiro en ser recoñecido por usar as tendencias na súa táboa periódica para predicir as propiedades dos elementos aínda non descubertos, como o galio e o xermanio.[86] A segunda decisión foi a de ignorar en determinadas ocasións a orde suxerida polos pesos atómicos e intercambiar elementos adxacentes, como o telurio e o iodo, para clasificalos mellor en familias químicas. Posteriormente en 1913, Henry Moseley determinou valores experimentais da carga nuclear (o número atómico) de cada elemento, demostrando que a orde de Mendeleiev correspondíase realmente coa orde do número atómico crecente.[87]
A importancia dos números atómicos para a organización da táboa periódica non foi apreciada ata que se acadou unha comprensión da existencia e propiedades dos protóns e neutróns. As táboas periódicas de Mendeleiev usaban o peso atómico no lugar do número atómico para organizar os elementos, unha información determinable ata un considerable grao de precisión na súa época. O peso atómico servía na maioría de casos para fornecer unha presentación capaz de predicir as propiedades de elementos aínda non descubertos de forma máis exacta que calquera outro método coñecido ata entón. A súa substitución polo número atómico ofreceu unha secuencia definitiva baseada en números enteiros para os elementos, e Moseley predixo en 1913 que os únicos elementos ausentes entre o aluminio (Z=13) e o ouro (Z=79) eran Z = 43, 61, 72 e 75, todos eles descubertos posteriormente. A secuencia de números atómicos continúa utilizándose aínda no estudo e produción de novos elementos sintéticos.[88]
Segunda versión e desenvolvemento posterior |

Táboa periódica de Mendeleiev de 1971 con oito grupos de elementos. Os guións representaban os elementos aínda non coñecidos naquel entón.
En 1871 Mendeleiev publicou a súa táboa periódica nun novo formato, con grupos de elementos semellantes dispostos en columnas en lugar de filas, numerando esas columnas de I a VIII correspondéndose co estado de oxidación dos elementos. Realizou tamén predicións detalladas das propiedades dalgúns elementos aínda non descubertos.[89] Estes baleiros fóronse enchendo subsecuentemente segundo os químicos foron descubrindo elementos adicionais de ocorrencia natural.[90] É común a afirmación de que o último elemento de ocorrencia natural descuberto foi o francio (chamado por Mendeleiev eka-cesio) en 1939.[91] Porén, o plutonio, producido de forma sintética en 1940 no contexto do Proxecto Manhattan, identificouse no ano 1971 como un elemento de ocorrencia natural en cantidades minúsculas.[92]
A disposición popular da táboa periódica, tamén coñecida como forma común ou estándar, atribúese ó químico estadounidense Horace Groves Deming.[29] En 1923 Deming publicou dúas táboas periódicas en formato curto[93] e mediano.[94][95][e] A empresa Merck and Company preparou unhas tarxetas da táboa mediana de 18 columnas de Deming en 1928, que circularon extensivamente polas escolas estadounidenses. En 1930 a táboa de Deming xa se incluía nos libros de texto e enciclopedias de química, e foi distribuída durante moitos anos pola empresa Sargent-Welch Scientific Company.[18][98][99]
Co desenvolvemento das teorías modernas de configuracións electrónicas dentro dos átomos da mecánica cuántica, fíxose aparente que cada período da táboa corresponde co enchido dunha capa cuántica de electróns. Os átomos máis grandes teñen máis subcapas de electróns, polo que as táboas posteriores foron requirindo períodos máis longos de forma progresiva.[100]
En 1945 o científico estadounidense Glenn T. Seaborg suxeriu que os elementos actínidos, ó igual que os lantánidos, enchían un subnivel f. Antes desta época críase que os actínidos formaban unha cuarta fila do bloque d. Os colegas de Seaborg aconselláronlle non publicar unha suxestión tan radical xa que probablemente arruinaría a súa carreira. Seaborg publicou o seu traballo de todas formas, xa que consideraba que entón aínda non tiña unha carreira que puidese desprestixiarse. A súa suxestión demostrou ser correcta e subsecuentemente gañou o premio Nobel de Química en 1951 polo seu traballo na síntese de elementos actínidos.[101][102][f]
Malia que existen cantidades minúsculas dalgúns elementos transuránicos de forma natural,[10] todos eles foron descubertos inicialmente en laboratorios. A súa produción expandiu a táboa periódica de forma significativa, sendo o primeiro destes o neptunio, producido de forma sintética por primeira vez en 1939.[104] Debido a que a maioría dos elementos transuránicos son altamente inestables e decaen moi rapidamente, resultan difíciles de detectar e caracterizar unha vez producidos. Houbo varias controversias relacionadas coa aceptación de afirmacións de descubrimento competidoras para algúns elementos, precisando unha revisión independente en cada caso para determinar que descubridor tiña a prioridade e polo tanto os dereitos de nomeamento.[105] No ano 2010, unha colaboración ruso-estadounidense en Dubna, Rusia, afirmou ter producido sinteticamente seis átomos de ténnesso (elemento 117), a afirmación de descubrimento máis recente. Xunto co nihonio (elemento 113), o moscovio (elemento 115) e o oganesson (elemento 118), estes catro foron os elementos de máis recente nomeamento, facéndose oficiais os seus nomes os 28 de novembro de 2016.[7][106]
Outras táboas periódicas |
Táboa de 32 columnas |

Táboa periódica en formato de 32 columnas
A táboa periódica moderna preséntase en ocasións en formato longo expandido de 32 columnas inserindo os elementos do bloque f na súa posición natural entre os bloques s e d. A diferenza do formato de 18 columnas, esta disposición non presenta separacións na secuencia crecente de números atómicos.[107] A relación do bloque f co resto de bloques da táboa periódica tamén resulta máis doada de apreciar.[108]William B. Jensen promulgou un formato de táboa con 32 columnas argumentando que os lantánidos e os actínidos quedan senón "relegados nas mentes dos estudantes a elementos pouco interesantes e sen importancia que poden ignorar e deixar en corentena".[109] Malia estas vantaxes os editores habitualmente evitan o formato de 32 columnas por mor da súa proporción non rectangular en comparación coa relación de aspecto das páxinas dos libros,[110] e pola familiaridade dos químicos coa forma moderna introducida por Seaborg.[111]
Táboas con estruturas diferentes |
- Artigo principal: Táboas periódicas alternativas.
Nos 100 anos posteriores á aparición da táboa de Mendeleiev en 1869 estimouse que se publicaron ó redor dunhas 700 versións diferentes da táboa periódica.[112] A maiores das diversas variacións rectangulares, deseñáronse outros formatos de táboa periódica, como por exemplo en círculo, cúbicas, cilíndricas, en espiral, en forma de lemniscasta, en forma de prismas octogonais, en forma de pirámide, esféricas ou triangulares.[113] Estas alternativas adoitan estar desenvolvidas para destacar ou poñer énfase nas propiedades físicas ou químicas dos elementos que non son tan aparentes nas táboas periódicas tradicionais.[112]

Táboa periódica en espiral de Theodor Benfey
Unha estrutura alternativa popular é a de Theodor Benfey de 1960.[114] Neste formato os elementos están dispostos nunha espiral continua, co hidróxeno no centro e os metais de transición, os lantánidos e os actínidos situados en penínsulas.[115]
A maioría de táboas periódicas son de dúas dimensións,[10] pero as táboas de tres dimensións xa apareceran en 1862, predatando a táboa de Mendeleiev. Os exemplos máis recentes deste tipo de táboas inclúen a clasificación periódica de Courtines de 1925,[116] o sistema de láminas de Wringley de 1949,[117] a hélice periódica de Giguère de 1965[118] e a árbore periódica de Dufour de 1996.[119] Ademais, a táboa periódica dos físicos de Stowe publicada en 1989[120] foi descrita como de catro dimensións, tendo tres dimensións espaciais e unha dimensión de cor.[121]
Segundo Eric Scerri, os diversos formatos de táboas periódicas poden considerarse situados nun continuo química–física.[122] Cara ó extremo químico deste continuo pode atoparse entre outras a táboa periódica de químicos inorgánicos de Rayner-Canham de 2002,[123] que pon énfase nas tendencias e padróns así como nas propiedades e relacións químicas pouco frecuentes.[124] Preto do extremo físico deste continuo estaría a táboa periódica de paso esquerdo de Charles Janet, publicada en 1928. Esta presenta unha estrutura cunha conexión máis próxima á orde na que se enchen as capas electrónicas e, por asociación, á mecánica cuántica.[125] Reuben Alper publicou no ano 2010 un enfoque semellante en certa medida,[126] mais criticado por Scerri por non respectar a necesidade de amosar a periodicidade química e física.[127] Na parte media do continuo estaría a forma común da táboa periódica, considerada unha mellor expresión das tendencias no estado físico, condutividade eléctrica e térmica, números de oxidación e outras propiedades facilmente inferidas a partir de técnicas tradicionais de laboratorio.[128] Considérase que a súa popularidade é resultado dun bo balance de características en termos de facilidade de construción e uso, e da súa representación da orde atómica e tendencias periódicas.[73][129]
Táboa periódica de paso esquerdo de Charles Janet | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | s1 | s2 | |
1s | H | He | ||||||||||||||||||||||||||||||
2s | Li | Be | ||||||||||||||||||||||||||||||
2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||
4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||
4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra |
5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | 119 | 120 |
| bloque f | bloque d | bloque p | bloque s | |||||||||||||||||||||||||||||
Táboas aplicadas noutros ámbitos |
A máis do obxectivo orixinal de clasificación dos elementos por propiedades periódicas, ó longo do tempo utilizouse a estrutura da táboa periódica para construír táboas con outros obxectivos.[130] Por exemplo, no ano 2019 incluíuse nun informe do Foro Económico Mundial sobre a reciclaxe de produtos electrónicos unha "táboa periódica" da reciclaxe.[131]
Cuestións abertas e controversias |
Situación do hidróxeno e do helio |
Seguindo unicamente as configuracións electrónicas, o hidróxeno (1s1) e o helio (1s2) deberían situarse nos grupos 1 e 2, sobre o litio ([He]2s1) e o berilio ([He]2s2) respectivamente.[29] Porén, esta colocación non se utiliza habitualmente fóra do propio contexto das configuracións electrónicas. Cando se descubriron por primeira vez os gases nobres ó redor do ano 1900 (chamados entón "gases inertes"), incluíronse no denominado "grupo 0", reflectindo desta forma que non se coñecía ata entón unha reactividade química destes elementos, e o helio situouse na parte superior dese grupo xa que compartía a inercia química común a ese grupo. Cando o grupo mudou o seu número formal, moitos autores continuaron situando o helio directamente sobre o neon no grupo 18,[132] incluíndo a táboa moderna da IUPAC.[133] A propiedade que distingue o helio do resto de gases nobres, malia a semellanza na súa inercia á do neon e á do argon, é que na súa capa electrónica pechada o helio só ten dous electróns no orbital máis exterior, mentres que o resto de gases nobres teñen oito.[134]
As propiedades químicas do hidróxeno non se asemellan moito ás dos alcalinos que ocupan o grupo 1, e seguindo esta base o hidróxeno sitúase en ocasións nun lugar distintos, sendo unha das alternativas máis habituais no grupo 17.[127] Un dos factores para isto é a química predominantemente non metálica e estritamente univalente do hidróxeno, e que o flúor é estritamente univalente e non metálico. En ocasións, para demostrar que o hidróxeno posúe propiedades que corresponden tanto ás dos alcalinos coma ás dos halóxenos, aparece representado nas dúas de forma simultánea.[135] Outra colocación suxerida é sobre o carbono no grupo 14. Situado desta forma encaixaría ben coas tendencias de valores crecentes de potencial de ionización e afinidade electrónica, e non estaría demasiado lonxe da tendencia da electronegatividade, malia que o hidróxeno non pode demostrar a característica tetravalente dos elementos máis pesados do grupo 14.[136] Finalmente o hidróxeno colócase en ocasións separado de tódolos grupos, baseándose en como as propiedades xerais do hidróxeno difiren das do resto de elementos. Isto tamén sucede en ocasións co helio, o outro elemento do período 1.[137]
Elementos do grupo 3 nos períodos 6 e 7 |
Aínda que o escandio e o itrio son sempre os dous primeiros elementos do grupo 3, a identidade dos dous elementos seguintes non está completamente establecida. O máis habitual é que sexan o lantano e o actinio, e o menos o lutecio e o laurencio. Estas dúas variantes xorden das dificultades históricas para situar os lantánidos na táboa periódica, e dos debates sobre onde comezan e terminan os elementos do bloque f.[138][g] A separación dos lantánidos do corpo principal da táboa periódica atribuíuse ó químico checo Bohuslav Brauner, que en 1902 situounos a todos nunha posición do grupo 4 baixo o circonio. Esta disposición recibiu o nome de "hipótese asteroide", como analoxía ós asteroides ocupando unha única órbita no sistema solar. Antes desta disposición os lantánidos situábanse xeralmente ó longo dos grupos I a VIII do formato antigo de 8 columnas da táboa. Malia que existen rexistros de predecesores da disposición de 1902 de Brauner que datan do ano 1895, este coñécese por facer referencia á "química dos asteroides" nunha carta de 1881 enviada a Mendeleiev. Outros autores asignaron tódolos lantánidos ben ó grupo 3, ós grupos 3 e 4, ou ós grupos 2, 3 e 4. En 1922 Niels Bohr continuou o proceso de separación situando os lantánidos entre os bloques s e d. En 1949 Glenn T. Seaborg reintroduciu o formato de táboa periódica máis popular, no que os lantánidos e actínidos aparecen no pé da táboa. Seaborg publicou a súa táboa por primeira vez nun informe clasificado de 1944, e publicouna de novo en 1945 en Chemical and Engineering News. Nos anos seguintes ata o ano 1949 varios autores comentaron a súa proposta e estiveron en xeral de acordo con ela. Nese ano Seaborg indicou que o mellor método para representar os actínidos semellaba ser o de situalos baixo os lantánidos como análogos destes.[138][140] Posteriormente chegouse a afirmar que estes debates son proba de que "é un erro dividir o sistema [periódico] en bloques pronunciadamente delimitados".[141] Existe tamén unha terceira variante representa as dúas posicións baixo o itrio ocupadas por tódolos lantánidos e actínidos.[142][143][144] Existen argumentos químicos e físicos apoiando o caso do lutecio e o laurencio,[138][145] mais a maioría de autores afirma non estar convencido disto.[146] En decembro de 2015 a IUPAC estableceu un proxecto para investigar e realizar unha recomendación formal para esta cuestión.[147]
Lantano e actinio |

La e Ac baixo Y
O lantano e o actinio adoitan representarse como os restantes membros do grupo 3.[148][149][150][151] Esta disposición tería a súa orixe nos anos 1940, coa aparición das táboas periódicas que dependían da configuración electrónica dos elementos e da noción do electrón de diferenciación. As configuracións do cesio, bario e lantano son [Xe]6s1, [Xe]6s2 e [Xe]5d16s2 respectivamente. O lantano ten un electrón de diferenciación 5d e segundo William B. Jensen isto estableceríao no grupo 3 como o primeiro membro do bloque d para o período 6.[152] Seguindo o razoamento de Jensen, un conxunto consistente de configuracións electrónicas pode verse desta forma no grupo 3: escandio [Ar]3d14s2, itrio [Kr]4d15s2 e lantano [Xe]5d16s2. Aínda no período 6, asignóuselle ó iterbio a configuración electrónica [Xe]4f135d16s2 e ó lutecio [Xe]4f145d16s2, dando como resultado un electrón de diferenciación 4f para o lutecio e establecéndoo como o último membro do bloque f para o período 6.[152] Jensen indica que os traballos espectroscópicos posteriores descubriron que a configuración electrónica do iterbio é realmente [Xe]4f146s2. Isto significa que o iterbio e o lutecio, este último cunha configuración electrónica de [Xe]4f145d16s2, teñen ámbolos dous 14 electróns f, dando como resultado un electrón de diferenciación d no lugar de f para o lutecio, e facendo deste un candidato igualmente válido que o lantano de configuración [Xe]5d16s2 para a posición do grupo 3 baixo o itrio.[152] Porén, o lantano presenta a vantaxe da incumbencia xa que o electrón 5d1 aparece por primeira vez na súa estrutura mentres que aparece por terceira vez na do lutecio, sendo a súa segunda aparición na estrutura do gadolinio.[153]
En termos de comportamento químico,[154] e tendencias ó descender polo grupo 3 para propiedades como o punto de fusión, a electronegatividade e o raio iónico,[155][156] o escandio, o itrio, o lantano e o actinio son semellantes ós seus elementos homólogos dos grupos 1 e 2. Nesta variante o número de electróns f nos ións máis comúns (trivalentes) dos elementos do bloque f, coinciden de forma consistente na súa posición no bloque f.[157] Por exemplo, a conta de electróns f para os ións trivalentes dos primeiros tres elementos do bloque f son Ce 1, Pr 2 e Nd 3.[158]
Lutecio e laurencio |

Lu e Lr baixo Y
Noutras táboas o lutecio e o laurencio dispóñense como os membros restantes do grupo 3.[159][160] As técnicas temperás de separación química do escandio, itrio e lutecio dependían do feito de que estes elementos danse xuntos no chamado "grupo itrio", mentres que o lantano e o actinio danse xuntos no chamado "grupo cerio".[152] De acordo a isto algúns químicos asignaron o lutecio ó grupo 3 no lugar do lantano nos anos 1920 e 1930.[h] Varios físicos favoreceron o lutecio nos anos 1950 e 1960, tendo en conta a comparación de varias das súas propiedades físicas coas do lantano.[152] Esta disposición, na que o lantano é o primeiro membro do bloque f, está disputada por varios autores xa que o lantano carece de electróns f. Porén, déronse argumentos de que esta non sería unha oposición válida por mor doutras das anomalías existentes na táboa periódica..[162] Para o laurencio, a súa configuración electrónica en fase atómica de gas quedou confirmada no ano 2015 como [Rn]5f147s27p1. Esta configuración representa outra anomalía na táboa periódica, independentemente de se o laurencio se sitúa no bloque f ou d, xa que a única posición potencial no bloque p reservouse para o nihonio coa súa configuración predita de [Rn]5f146d107s27p1.[163][i]
Quimicamente o escandio, o itrio e o lutecio (e presumiblemente o laurencio) compórtanse como versións trivalentes dos metais do grupos 1 e 2.[165] Por outra banda, as tendencias ó desprazarse cara abaixo no grupo para propiedades como o punto de fusión, electronegatividade e raio iónico son semellantes ás que se atopan entre os seus homólogos dos grupos 4 a 8.[152] Nesta variante o número de electróns f nas formas gasosas dos átomos do bloque f adoitan coincidir coa súa posición no bloque f. Por exemplo, as contas de electróns f para os primeiros cinco elementos do bloque f son La 0, Ce 1, Pr 3, Nd 4 and Pm 5.[152]
Lantánidos e actínidos |

Marcadores baixo Y
Uns poucos autores sitúan todos os trinta lantánidos e actínidos nas dúas posicións baixo o itrio, habitualmente por medio de marcas e notas ó pé. Esta variante pon énfase nas semellanzas químicas dos 15 lantánidos, a expensas da ambigüidade resultante sobre que dous elementos ocupan as posicións do grupo 3 baixo o itrio e dun teórico bloque f de 15 columnas.[142][143][144]
Grupos incluídos nos metais de transición |
Segundo a definición da IUPAC un metal de transición é un elemento cuxo átomo ten unha subcapa d incompleta, ou que pode dar lugar a catións cunha subcapa d incompleta. Segundo esta definición tódolos elementos dos grupos do 3 ó 11 son metais de transición, excluíndo desta categoría ós elementos do grupo 12: cinc, cadmio e mercurio.[166]
Algúns químicos tratan as categorías "elementos do bloque d" e "metais de transición" de forma intercambiable, e polo tanto inclúen os grupos do 3 ó 12 entre os metais de transicións. Nesta consideración os elementos do grupo 12 trátanse como un caso especial de metais de transición no que os electróns d non están involucrados no enlace químico de forma ordinaria. Un estudo de 2007 sobre o fluoruro de mercurio (VI) (HgF4), un composto no que o mercurio usaría os seus electróns d para o enlace, deu lugar á suxestión de que o mercurio podería considerarse un metal de transición.[167] Outros autores como Jensen argumentaron que a formación dun composto como o HgF4 pode suceder só baixo condicións moi anormais, e a súa propia existencia está en disputa, polo que o mercurio non podería considerarse un metal de transición seguindo unha interpretación razoable da definición ordinaria.[168]
Por outra banda hai químicos que exclúen os elementos do grupo 3 da definición de metal de transición, baseándose en que os elementos deste grupo non forman ningún ión cunha capa d parcialmente ocupada e polo tanto non presentan ningunha propiedade característica da química dos metais de transición.[169] Neste caso só se consideran os grupos do 4 ó 11 como metais de transición. Non obstante, malia que os elementos do grupo 3 teñen poucas propiedades químicas características dos metais de transición, si demostran algunhas das propiedades físicas características destes, pola presenza dun único electrón d en cada un dos seus átomos.[57]
Elementos con propiedades químicas descoñecidas |
Aínda que foron descubertos todos os elementos ata o oganesson, dos elementos por riba do hassio (elemento 108) só o copernicio (elemento 112), o nihonio (elemento 113) e o flerovio (elemento 114) teñen propiedades químicas coñecidas, e só hai suficiente evidencia dunha categoría conclusiva para o copernicio. Os outros elementos poderían comportarse de forma distinta da predición por extrapolación, por mor de efectos relativistas. Por exemplo, a predición indica que o flerovio exhibiría algunhas propiedades semellantes ós gases nobres, malia que se sitúa no grupo do carbono.[170] Experimentos máis recentes suxeriron por outra banda que o flerovio comportaríase quimicamente como o chumbo, como se agardaría da súa posición na táboa periódica.[171]
Extensións adicionais da táboa periódica |
- Artigo principal: Táboa periódica estendida.
Non está claro se os elementos continuarán o padrón da táboa periódica actual nun período 8 ou se serán precisos axustes e adaptacións adicionais. Seaborg teorizou que o oitavo período seguiría o padrón establecido previamente de forma exacta, polo que incluiría un bloque s de dous elementos para o 119 e o 120, un novo bloque g para os seguintes 18 elementos e 30 elementos adicionais continuando os bloques f, d e p actuais, culminando no elemento 168 que sería o seguinte gas nobre.[172] Máis recentemente químicos como Pekka Pyykkö teorizaron que estes elementos adicionais non seguirían a regra de Madelung, que predí como se enchen as capas de electróns, polo que afectarían á aparencia da táboa periódica. Existen varios modelos teóricos competidores para a colocación dos elementos de número atómico 172 e inferiores.[173]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Elemento co maior número atómico posible |
Descoñécese o número exacto de elementos posibles. Unha teoría temperá proposta por Elliot Adams en 1911 e baseada na disposición dos elementos en cada unha das filas horizontais da táboa periódica indicaba que os elementos de peso atómico maior de 256± (ós elementos 99 ou 100) non existirían.[175] Unha estimación máis recente é que a táboa periódica podería rematar pouco despois da denominada illa de estabilidade,[176] que se centraría ó redor do elemento 126, xa que a extensión da táboa periódica e de núcleos está restrinxida polas liñas de goteo.[177] Outras predicións de onde remataría a táboa periódica inclúen no elemento 128 por parte de John Emsley,[10] no elemento 137 por parte de Richard Feynman,[178] e no elemento 155 por parte de Albert Khazan.[10][j]
O modelo de Bohr presenta dificultades para os átomos de número atómico maior de 137, xa que segundo ese modelo calquera elemento cun número atómico maior que 137 requiriría que os electróns 1s se desprazasen máis rápido que a velocidade da luz.[180] A ecuación relativista de Dirac presenta problemas para os elementos con máis de 137 protóns. Para estes elementos a función de onda no estado fundamental de Dirac é oscilatoria en lugar de fixa, e non hai espazo entre o espectro de enerxía positivo e negativo, como se pode ver no paradoxo de Klein.[181] Cálculos máis precisos tendo en conta os efectos do tamaño finito do núcleo indican que a enerxía de unión excede o límite por primeira vez para os elementos con máis de 173 protóns. Para os elementos máis pesados se non se enche o orbital máis interno 1s o campo eléctrico do núcleo tira un electrón do baleiro, dando como resultado a emisión espontánea dun positrón.[182] Porén, isto non sucede se o orbital máis interno está cheo, polo que o elemento 173 non sería necesariamente o último da táboa periódica.[178]
Formato óptimo |
Os múltiples formatos e versións de táboas periódicas existentes deron lugar á pregunta de se existe un formato óptimo ou definitivo da táboa periódica.[183] Segundo Eric Scerri, a resposta dependería se a periodicidade química observada entre os elementos ten unha verdade absoluta ou se é o produto da interpretación humana.[184] Scerri postula que moitos dos diferentes formatos de táboas periódicas poden considerarse como variacións da temática da periodicidade química, cada unha delas explorando e dándolle énfase a diferentes aspectos, propiedades, perspectivas e relacións entre os elementos.[185][184]
Notas |
↑ Danse algunhas inconsistencias e irregularidades ó seguir esta convención. Entre outras, o helio represéntase no bloque p pero realmente é un elemento do bloque s,[30] e a subcapa d do bloque d xa está chea nos elementos do grupo 11 en lugar dos do 12.[31]
↑ Non se inclúen neste gráfico os gases nobres, o ástato, o francio e os elementos máis pesados que o americio.
↑ Malia que o flúor é o elemento máis electronegativo segundo a escala Pauling, o neon é o elemento máis electronegativo segundo outras escalas, como por exemplo a escala Allen.[43]
↑ Malia que as investigacións indican que o laurencio tería un electrón p no lugar dun electrón d na súa configuración electrónica no seu estado fundamental, e polo tanto agardaríase que fose un metal volátil capaz de formar un catión +1 nunha solución, non se puido obter evidencia de ningunha destas propiedades malia os diversos experimentos realizados.[60] Orixinalmente agardábase que tivese un electrón d na súa configuración electrónica,[60] sendo posible no caso do laurencio metálico, mais no laurencio en fase atómica de gas tería con toda probabilidade un electrón p.[61]
↑ Un antecedente da táboa de 18 columnas de Deming pode verse na táboa periódica de 16 columnas de Adams de 1911.[96] Adams omitiu as terras raras e os "elementos radioactivos" (os actínidos) do corpo principal da súa táboa e no seu lugar "incluíunos nas marxes para aforrar espazo".[97]
↑ En 1892 xa se postulara unha segunda fila da táboa máis longa, para acomodar os elementos coñecidos e aínda por descubrir cun peso atómico maior ó do bismuto, como o torio, o protactinio ou o uranio entre outros. Porén, a maioría de investigadores consideraron que eses elementos eran análogos ós da terceira serie de elementos de transición, o hafnio, o tántalo e o volframio. A existencia dunha segunda serie interior de transición, na forma dos actínidos, non se aceptou ata que se estableceron as semellanzas coas estruturas electrónicas dos lantánidos.[103]
↑ Para a propia existencia dos lantánidos a composición do grupo 3 non é fonte de ningún interese específico, xa que o escandio, o itrio o lantano e o actinio presentan o mesmo cambio gradual en propiedades que o calcio, o estroncio o bario e o radio no grupo 2.[139]
↑ O fenómeno de distintos grupos de separación está causado por unha crecente basicidade co incremento do raio, e non constitúe un motivo fundamental para representar o lutecio baixo o itrio no lugar do lantano. Desta forma entre os metais alcalinotérreos do grupo 2, o magnesio (menos básico) pertence ó "grupo soluble" e o calcio, estroncio e bario (máis básicos) danse no "grupo do carbonato de amoníaco". Non obstante, o magnesio, calcio, estroncio e bario sitúanse de forma rutineira no grupo 2 da táboa periódica.[161]
↑ Aínda que o laurencio metálico posúe un electrón p, os estudos de modelaxe simple suxiren que o seu comportamento é o dun lantánido,[164] ó igual que o resto dos últimos actínidos.[158]
↑ Karol argumenta que os efectos gravitacionais tornaríanse significativos cando os números atómicos pasan a ser astronomicamente grandes, superando polo tanto outros fenómenos de inestabilidade de núcleos supermasivos, e que as estrelas de neutróns (con números atómicos da orde de 1021) poden considerarse como representantes dos elementos máis pesados no Universo.[179]
- Referencias
Todas as referencias en inglés agás cando se indique o contrario.
↑ Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure Appl. Chem. 88 (3): 265–91. ISSN 0033-4545. doi:10.1515/pac-2015-0305.
↑ Greenwood & Earnshaw 1984, pp. 24–27.
↑ Gray 2009, p. 6.
↑ Strickland, Ashley. "New elements on the periodic table are named". CNN. Arquivado dende o orixinal o 10 de xuño de 2016. Consultado o 11 de xuño de 2016.
↑ "Discovery and assignment of elements with atomic numbers 113, 115, 117 and 118". IUPAC. 30 de decembro de 2015. Arquivado dende o orixinal o 13 de xuño de 2016.
↑ "Hello, Nihonium. Scientists Name 4 New Elements On The Periodic Table". NPR.org. Arquivado dende o orixinal o 10 de xuño de 2016. Consultado o 11 de xuño de 2016.
↑ 7,07,1 Kemsley, Jyllian (5 de decembro de 2016). "Names for elements 113, 115, 117, and 118 finalized by IUPAC". Chemical & Engineering News 94 (48): 7.
↑ "Chemistry: Four elements added to periodic table". BBC News. 4 de xaneiro de 2016. Arquivado dende o orixinal o 4 de xaneiro de 2016.
↑ St. Fleur, Nicholas (1 de decembro de 2016). "Four New Names Officially Added to the Periodic Table of Elements". New York Times. Arquivado dende o orixinal o 14 de agosto de 2017.
↑ 10,010,110,210,310,4 Emsley 2011.
↑ Silva, Robert J. (2006). "Fermium, Mendelevium, Nobelium and Lawrencium". En Morss, L. R.; Edelstein, N. M.; Fuger, J. The Chemistry of the Actinide and Transactinide Elements (3ª ed.). Dordrecht: Springer Science+Business Media. ISBN 1-4020-3555-1.
↑ Scerri 2007, p. 24.
↑ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. p. 32. ISBN 0-7637-7833-8.
↑ Bagnall, K. W. (1967). "Recent advances in actinide and lanthanide chemistry". En Fields, P. R.; Moeller, T. Advances in chemistry, Lanthanide/Actinide chemistry. Advances in Chemistry 71. American Chemical Society. pp. 1–12. ISBN 0-8412-0072-6. doi:10.1021/ba-1967-0071.
↑ Day, M. C., Jr.; Selbin, J. (1969). Theoretical inorganic chemistry (2ª ed.). Nova York: Nostrand-Rienhold Book Corporation. p. 103. ISBN 0-7637-7833-8.
↑ Holman, J.; Hill, G. C. (2000). Chemistry in context (5ª ed.). Walton-on-Thames: Nelson Thornes. p. 40. ISBN 0-17-448276-0.
↑ 17,017,1 Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 0-632-02494-1.
↑ 18,018,1 Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. (IUPAC) 60 (3): 431–436. doi:10.1351/pac198860030431. Arquivado (PDF) dende o orixinal o 25 de marzo de 2012. Consultado o 24 de marzo de 2012.
↑ 19,019,1 Moore, J. T. (2003). Chemistry For Dummies. For Dummies (1ª ed.). Nova York: Wiley Publications. p. 111. ISBN 978-0-7645-5430-8.
↑ 20,020,120,2 Greenwood & Earnshaw 1984, p. 30.
↑ "The constitution of group 3 of the periodic table". IUPAC. 18 de decembro de 2015.
↑ Brescia, Frank (2012). Fundamentals of Chemistry: A Modern Introduction. Elsevier. p. 134. ISBN 9780323142311.
↑ Satake, M. (2010). Periodic Table & Periodic Properties. Discovery Publishing House. p. 6. ISBN 9788171411610.
↑ Connelly, NG; Damhus, T, eds. (2005). "section IR-3.5: Elements in the periodic table". Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005 (PDF). Cambridge: RSC Publishing. p. 51. ISBN 0-85404-438-8.
↑ Weller, Mark; Overton, Tina; Rourke, Jonathan; Armstrong, Fraser (2014). Inorganic Chemistry. Oxford University Press. p. 298. ISBN 9780199641826.
↑ Stoker, S. H. (2007). General, organic, and biological chemistry. Nova York: Houghton Mifflin. p. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
↑ Mascetta, J. (2003). Chemistry The Easy Way (4ª ed.). Nova York: Hauppauge. p. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
↑ Kotz, J.; Treichel, P.; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (7ª ed.). Belmont: Thomson Brooks/Cole. p. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
↑ 29,029,129,2 Gray 2009, p. 12.
↑ Scerri, Eric R. (2008). Collected Papers on Philosophy of Chemistry. World Scientific. p. 177. ISBN 9781848161375.
↑ "Transition elements (The d-block elements)". Competition Science Vision (Pratiyogita Darpan) 2 (16): 472. 1999.
↑ Jones, C. (2002). d- and f-block chemistry. Nova York: J. Wiley & Sons. p. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
↑ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (4ª ed.). Nova York: McGraw-Hill. p. 536. ISBN 0-07-111658-3.
↑ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. p. 376. ISBN 0-87170-825-6.
↑ Bullinger, H-J. (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. p. 8. ISBN 978-3-540-88545-0.
↑ 36,036,1 Myers, R. (2003). The basics of chemistry. Westport: Greenwood Publishing Group. pp. 61–67. ISBN 0-313-31664-3.
↑ 37,037,1 Chang 2002, pp. 289–310; 340–42.
↑ Greenwood & Earnshaw 1984, p. 27.
↑ 39,039,1 Jolly, W. L. (1991). Modern Inorganic Chemistry (2ª ed.). McGraw-Hill. p. 22. ISBN 978-0-07-112651-9.
↑ 40,040,140,2 Greenwood & Earnshaw 1984, p. 28.
↑ "Electronegativity". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
↑ Pauling, L. (1932). "The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms". Journal of the American Chemical Society 54 (9): 3570–3582. Bibcode:1932JAChS..54.2610C. doi:10.1021/ja01348a011.
↑ Allen, Leland C. (1989). "Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms". Journal of the American Chemical Society 111 (25): 9003–9014. doi:10.1021/ja00207a003.
↑ Allred, A. L. (1960). "Electronegativity values from thermochemical data". Journal of Inorganic and Nuclear Chemistry (Northwestern University) 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5.
↑ 45,045,1 Huheey, Keiter & Keiter 1997, p. 42.
↑ 46,046,1 Chang 2002, pp. 307–309.
↑ Siekierski, S.; Burgess, J. (2002). Concise chemistry of the elements. Chichester: Horwood Publishing. pp. 35‒36. ISBN 1-898563-71-3.
↑ Huheey, Keiter & Keiter 1997, pp. 880–881.
↑ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975). Chemistry (2ª ed.). Harcourt Brace Jovanovich. p. 58. ISBN 0-15-506465-7.
↑ Huheey, Keiter & Keiter 1997, pp. 880–885.
↑ Sacks, O. (2009). Uncle Tungsten: Memories of a chemical boyhood. Nova York: Alfred A. Knopf. pp. 191, 194. ISBN 0-375-70404-3.
↑ Gray 2009, p. 9.
↑ 53,053,1 MacKay, K. M.; MacKay, R. A.; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (6ª ed.). Cheltenham: Nelson Thornes. pp. 194–196. ISBN 0-7487-6420-8.
↑ Remy, H. (1956). Kleinberg, J., ed. Treatise on Inorganic Chemistry 2. Ámsterdam: Elsevier. p. 30.
↑ Phillips, C. S. G.; Williams, R. J. P. (1966). Inorganic Chemistry. Oxford: Clarendon Press. pp. 4–5.
↑ King, R. B. (1995). Inorganic chemistry of main group elements. Nova York: Wiley-VCH. p. 289.
↑ 57,057,1 Greenwood & Earnshaw 1984, p. 947.
↑ Spedding, F. H.; Beadry, B. J. (1968). "Lutetium". En Hampel, C. A. The Encyclopedia of the Chemical Elements. Reinhold Book Corporation. pp. 374–378.
↑ Settouti, N.; Aourag, H. (2014). "A Study of the Physical and Mechanical Properties of Lutetium Compared with Those of Transition Metals: A Data Mining Approach". JOM 67 (1): 87–93. Bibcode:2015JOM....67a..87S. doi:10.1007/s11837-014-1247-x.
↑ 60,060,160,2 Silva, Robert J. (2011). "Chapter 13. Fermium, Mendelevium, Nobelium, and Lawrencium". En Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements. Países Baixos: Springer. ISBN 978-94-007-0210-3. doi:10.1007/978-94-007-0211-0_13.
↑ 61,061,1 Sato, T. K.; Asai, M.; Borschevsky, A.; Stora, T.; Sato, N.; Kaneya, Y.; Tsukada, K.; Düllman, Ch. E.; Eberhardt, K.; Eliav, E.; Ichikawa, S.; Kaldor, U.; Kratz, J. V.; Miyashita, S.; Nagame, Y.; Ooe, K.; Osa, A.; Renisch, D.; Runke, J.; Schädel, M.; Thörle-Pospiech, P.; Toyoshima, A.; Trautmann, N. (9 de abril de 2015). "Measurement of the first ionization potential of lawrencium, element 103" (PDF). Nature 520: 209–11. Bibcode:2015Natur.520..209S. doi:10.1038/nature14342.
↑ Steele, D. The Chemistry of the Metallic Elements. Oxford: Pergamon Press. p. 67. ISBN 9781483181028.
↑ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements (2ª ed.). Oxford: Elsevier Science Ltd. p. 1206. ISBN 0-7506-3365-4.
↑ MacKay, K. M.; MacKay, R. A.; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (6ª ed.). Cheltenham: Nelson Thornes. pp. 194–196, 385. ISBN 0-7487-6420-8.
↑ Siegfried, R. (2002). From elements to atoms a history of chemical composition. Filadelfia: Library of Congress Cataloging-in-Publication Data. p. 92. ISBN 0-87169-924-9.
↑ 66,066,1 Ball 2002, p. 100.
↑ Horvitz, L. (2002). Eureka!: Scientific Breakthroughs That Changed The World. Nova York: John Wiley. p. 43. ISBN 978-0-471-23341-1. OCLC 50766822.
↑ Aug. Kekulé (1857). "Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale". Annalen der Chemie und Pharmacie 104 (2): 129–150. doi:10.1002/jlac.18571040202.
↑ van Spronsen, J. W. (1969). The periodic system of chemical elements. Ámsterdam: Elsevier. p. 19. ISBN 0-444-40776-6.
↑ "Alexandre-Emile Bélguier de Chancourtois (1820–1886)" (en francés). Annales des Mines history page. Arquivado dende o orixinal o 27 de novembro de 2014. Consultado o 18 de setembro de 2014.
↑ Venable 1896, pp. 85–86, 97.
↑ Odling, W. (2002). "On the proportional numbers of the elements". Quarterly Journal of Science 1: 642–648.
↑ 73,073,1 Scerri 2011.
↑ Kaji, M. (2004). "Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s". En Rouvray, D. H.; King, R. Bruce. The periodic table: Into the 21st Century. Research Studies Press. p. 95. ISBN 0-86380-292-3.
↑ Newlands, J. A. R. (20 de agosto de 1864). "On Relations Among the Equivalents". Chemical News 10: 94–95. Arquivado dende o orixinal o 1 de xaneiro de 2011.
↑ Newlands, J. A. R. (18 de agosto de 1865). "On the Law of Octaves". Chemical News 12: 83. Arquivado dende o orixinal o 1 de xaneiro de 2011.
↑ Bryson, B. (2004). A Short History of Nearly Everything. Black Swan. pp. 141–142. ISBN 978-0-552-15174-0.
↑ Scerri 2007, p. 306.
↑ Brock, W. H.; Knight, D. M. (1965). "The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society'". Isis (The University of Chicago Press) 56 (1): 5–25. doi:10.1086/349922.
↑ Scerri 2007, pp. 87, 92.
↑ Kauffman, G. B. (1969). "American forerunners of the periodic law". Journal of Chemical Education 46 (3): 128–135 (132). Bibcode:1969JChEd..46..128K. doi:10.1021/ed046p128.
↑ Mendelejew, D. (1869). "Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente". Zeitschrift für Chemie (en alemán): 405–406.
↑ Venable 1896, pp. 96–97, 100–102.
↑ Ball 2002, pp. 100–102.
↑ Pullman, B. (1998). The Atom in the History of Human Thought. Traducido por Axel Reisinger. Oxford University Press. p. 227. ISBN 0-19-515040-6.
↑ Ball 2002, p. 105.
↑ Atkins, P. W. (1995). The Periodic Kingdom. HarperCollins Publishers, Inc. p. 87. ISBN 0-465-07265-8.
↑ Samanta, C.; Chowdhury, P. Roy; Basu, D. N. (2007). "Predictions of alpha decay half-lifes of heavy and superheavy elements". Nucl. Phys. A 789: 142–154. Bibcode:2007NuPhA.789..142S. arXiv:nucl-th/0703086. doi:10.1016/j.nuclphysa.2007.04.001.
↑ Scerri 2007, p. 112.
↑ Kaji, M. (2002). "D. I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry" (PDF). Bull. Hist. Chem. 27 (1): 4–16. Arquivado (PDF) dende o orixinal o 6 de xullo de 2016.
↑ Adloff, J-P.; Kaufman, G. B. (25 de setembro de 2005). "Francium (Atomic Number 87), the Last Discovered Natural Element". The Chemical Educator. Arquivado dende o orixinal o 4 de xuño de 2013. Consultado o 26 de marzo de 2007.
↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). "Detection of Plutonium-244 in Nature". Nature 234 (5325): 132–134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0. Arquivado dende o orixinal o 23 de xuño de 2011.
↑ Leach, Mark R. "Deming’s Other 1923 Periodic Table: Mendeleev style". Chemogenesis. Consultado o 20 de decembro de 2017.
↑ Leach, Mark R. "Deming Periodic Table". Chemogenesis. Consultado o 20 de decembro de 2017.
↑ Deming, H. G. (1923). General chemistry: An elementary survey. New York: J. Wiley & Sons. pp. 160, 165.
↑ Leach, Mark R. "Adams' Periodic Table". Chemogenesis. Consultado o 20 de decembro de 2017.
↑ Elliot, Q. A. (1911). "A modification of the periodic table". Journal of the American Chemical Society 33 (5): 684–688.
↑ Abraham, M.; Coshow, D.; Fix, W. Periodicity:A source book module, version 1.0 (PDF). Nova York: Chemsource, Inc. p. 3. Arquivado dende o orixinal (PDF) o 14 de maio de 2012.
↑ Emsley, J. (7 de marzo de 1985). "Mendeleyev's dream table". New Scientist 105 (1446): 32–36. ISSN 0262-4079.
↑ Ball 2002, p. 111.
↑ Scerri 2007, pp. 270‒271.
↑ Masterton, W. L.; Hurley, C. N.; Neth, E. J. Chemistry: Principles and reactions (7ª ed.). Belmont: Brooks/Cole Cengage Learning. p. 173. ISBN 1-111-42710-0.
↑ Van Spronsen, J. W. (1969). The periodic system of chemical elements. Ámsterdam: Elsevier. pp. 315–316. ISBN 0-444-40776-6.
↑ Ball 2002, p. 123.
↑ Barber, R. C.; Karol, P. J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, E. W. (2011). "Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report)". Pure Appl. Chem. 83 (7): 1485. doi:10.1351/PAC-REP-10-05-01.
↑ Эксперимент по синтезу 117-го элемента получает продолжение [O experimento na síntese do 117º elemento vai continuar] (en ruso). JINR. 2012. Arquivado dende o orixinal o 1 de agosto de 2013.
↑ Scerri, Eric (2013). "Element 61—Promethium". A Tale of 7 Elements. New York: Oxford University Press (USA). pp. 175–194(190). ISBN 978-0-19-539131-2. Arquivado dende o orixinal o 10 de setembro de 2017.
↑ Newell, S. B. (1980). Chemistry: An introduction. Boston: Little, Brown and Company. p. 196. ISBN 978-0-316-60455-0.
↑ Jensen, W. B. (1982). "Classification, Symmetry and the Periodic Table". Computers & Mathematics with Applications 12B (1/2): 487–510(498). doi:10.1016/0898-1221(86)90167-7.
↑ Leach, M. R. "Concerning electronegativity as a basic elemental property and why the periodic table is usually represented in its medium form". Foundations of Chemistry 15 (1): 13–29. doi:10.1007/s10698-012-9151-3.
↑ Thyssen, P.; Binnemans, K. (2011). Gschneidner Jr., K. A.; Bünzli, J-C.G; Vecharsky, Bünzli, eds. Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis. Handbook on the Physics and Chemistry of Rare Earths 41 (Ámsterdam: Elsevier). p. 76. ISBN 978-0-444-53590-0.
↑ 112,0112,1 Scerri 2007, p. 20.
↑ Leach, Mark R. "All Periodic Tables in the INTERNET Periodic Table Database". Chemogenesis. Consultado o 20 de decembro de 2012.
↑ Emsely, J.; Sharp, R. (21 de xuño de 2010). "The periodic table: Top of the charts". The Independent. Arquivado dende o orixinal o 1 de xullo de 2017.
↑ Seaborg, G. (1964). "Plutonium: The Ornery Element". Chemistry 37 (6): 14.
↑ Leach, Mark R. "1925 Courtines' Periodic Classification". Chemogenesis. Arquivado dende o orixinal o 16 de maio de 2016. Consultado o 16 de outubro de 2012.
↑ Leach, Mark R. "1949 Wringley's Lamina System". Chemogenesis. Arquivado dende o orixinal o 3 de decembro de 2011. Consultado o 16 de outubro de 2012.
↑ Mazurs, E. G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. p. 111. ISBN 978-0-8173-3200-6.
↑ Leach, Mark R. "1996 Dufour's Periodic Tree". Chemogenesis. Arquivado dende o orixinal o 18 de abril de 2010. Consultado o 16 de outubro de 2012.
↑ Leach, Mark R. "1989 Physicist's Periodic Table by Timothy Stowe". Chemogenesis. Arquivado dende o orixinal o 5 de xuño de 2012. Consultado o 16 de outubro de 2012.
↑ Bradley, D. (20 de xullo de 2011). "At last, a definitive periodic table?". ChemViews Magazine. doi:10.1002/chemv.201000107. Arquivado dende o orixinal o 1 de maio de 2013.
↑ Scerri 2007, pp. 285‒86.
↑ Leach, Mark R. "2002 Inorganic Chemist's Periodic Table". Arquivado dende o orixinal o 9 de marzo de 2013. Consultado o 16 de outubro de 2012.
↑ Scerri 2007, p. 285.
↑ Scerri, E. (2008). "The role of triads in the evolution of the periodic table: Past and present". Journal of Chemical Education 85 (4): 585–89. Bibcode:2008JChEd..85..585S. doi:10.1021/ed085p585.
↑ Alper, R. (2010). "The simplified periodic table: elements ordered by their subshells". The Journal of Biological Physics and Chemistry 10 (2): 74–80. doi:10.4024/43AL09F.jbpc.10.02.
↑ 127,0127,1 Scerri, E. (2012). "Some comments on the recently proposed periodic table featuring elements ordered by their subshells". Journal of Biological Physics and Chemistry 12 (2): 69–70.
↑ Bent, H. A.; Weinhold, F. (2007). "Supporting information: News from the periodic table: An introduction to "Periodicity symbols, tables, and models for higher-order valency and donor–acceptor kinships"". Journal of Chemical Education 84 (7): 3–4. doi:10.1021/ed084p1145.
↑ Francl, M. (2009). "Table manners" (PDF). Nature Chemistry 1 (2): 97–98. Bibcode:2009NatCh...1...97F. PMID 21378810. doi:10.1038/nchem.183. Arquivado (PDF) dende o orixinal o 25 de outubro de 2012.
↑ Álvarez, Clemente (25 de xaneiro de 2019). "Tres tablas periódicas que explican el irracional consumo de muchos aparatos electrónicos". eldiario.es (en castelán). Consultado o 27 de xaneiro de 2019.
↑ A New Circular Vision for Electronics (PDF) (Informe) (en inglés). Foro Económico Mundial. 2019. p. 8.
↑ Scerri, Eric (1 de xaneiro de 2012). "Trouble in the periodic table". Education in Chemistry. Consultado o 21 de decembro de 2017.
↑ "IUPAC Periodic Table of the Elements" (PDF). IUPAC. 2013-05-01. Arquivado (PDF) dende o orixinal o 22 de agosto de 2015. Consultado o 20 de setembro de 2015.
↑ Lewars, Errol G. (2008-12-05). Modeling Marvels: Computational Anticipation of Novel Molecules. Springer Science & Business Media. pp. 69–71. ISBN 978-1-4020-6973-4. Arquivado dende o orixinal o 19 de maio de 2016.
↑ Seaborg, G. (1945). "The chemical and radioactive properties of the heavy elements". Chemical English Newspaper 23 (23): 2190–2193.
↑ Cronyn, M. W. (2003). "The Proper Place for Hydrogen in the Periodic Table". Journal of Chemical Education 80 (8): 947–951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
↑ Greenwood & Earnshaw 1984.
↑ 138,0138,1138,2 Thyssen, P.; Binnemans, K. (2011). Gschneidner Jr., K. A.; Bünzli, J-C.G; Vecharsky, Bünzli, eds. Accommodation of the Rare Earths in the Periodic Table: A Historical Analysis. Handbook on the Physics and Chemistry of Rare Earths 41 (Amsterdam: Elsevier). pp. 1–94. ISBN 978-0-444-53590-0.
↑ Hevesy, G. (1929). Redkie zemeli s tochki zreniya stroeniya atoma [Terras raras dende o punto de vista da estrutura do átomo] (citado en Trifonov 1970, p. 188) (en ruso). Leningrado: NKhTI.
↑ Seaborg G. T. (1994). Origin of the Actinide Concept'. In K. A. Gschneider Jr. (ed). Handbook on the Physics and Chemistry of the Rare Earths. 18. Amsterdam: Elsevier, pp. 1–27.
↑ Stewart, P. J. (2008). "The Flyleaf Table: An Alternative". Journal of Chemical Education 85 (11): 1490. Bibcode:2008JChEd..85.1490S. doi:10.1021/ed085p1490.
↑ 142,0142,1 Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3ª ed.). Harlow: Pearson Education. ISBN 9780131755536.
↑ 143,0143,1 Halliday, D.; Resnick, R.; Walker, J. (2005). Fundamentals of Physics (7ª ed.). Hoboken, Nova Jersey: John Wiley & Sons. ISBN 9780471658856.
↑ 144,0144,1 Nebergall, W. H. (1980). General Chemistry (6ª ed.). Lexington: D. C. Heath and Company. ISBN 0669022187. OL 4435314M.
↑ Keeler, J.; Wothers, P. (2014). Chemical Structure and Reactivity: An Integrated Approach. Oxford University Press. p. 259. ISBN 978-0-19-960413-5.
↑ Scerri, E. (2012). "Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3?". Chemistry International 34 (4). Arquivado dende o orixinal o 10 de setembro de 2017.
↑ "The constitution of group 3 of the periodic table". IUPAC. 2015. Arquivado dende o orixinal o 5 de xullo de 2016. Consultado o 30 de xullo de 2016.
↑ Emsley 2011, p. 651.
↑ Atkins, Peter; Shriver, Duwar (2006). Shriver & Atkins Inorganic Chemistry (4ª ed.). Oxford University Press. ISBN 9780716748786.
↑ Myers, R. Thomas; Oldham, Keith B.; Tocci, Salvatore (2004). Holt Chemistry. Orlando: Holt, Rinehart & Winston. ISBN 9780030664625.
↑ Chang, R. (2000). Essential Chemistry: A Core Text for General Chemistry (2ª ed.). Boston: McGraw-Hill. ISBN 978-0072412147.
↑ 152,0152,1152,2152,3152,4152,5152,6 William B. Jensen (1982). "The Positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the Periodic Table". J. Chem. Educ. 59 (8): 634–636. Bibcode:1982JChEd..59..634J. doi:10.1021/ed059p634.
↑ Trifonov, D. N. (1970). Rare-earth elements and their position in the periodic system (tradución do ruso). Nova Deli: Indian National Scientific Documentation Centre. pp. 201–202.
↑ Greenwood, N. N.; Harrington, T. J. (1973). The chemistry of the transition elements. Oxford: Clarendon Press. p. 50. ISBN 0-19-855435-4.
↑ Aylward, G.; Findlay, T. (2008). SI chemical data (6ª ed.). Milton, Queensland: John Wiley & Sons. ISBN 978-0-470-81638-7.
↑ Wiberg, N. (2001). Inorganic Chemistry. San Diego: Academic Press. p. 119. ISBN 0-12-352651-5.
↑ Wulfsberg, G. (2006). "Periodic table: Trends in the properties of the elements". Encyclopedia of Inorganic Chemistry. Nova York: John Wiley & Sons. p. 3. ISBN 978-0-470-86210-0.
↑ 158,0158,1 Cotton, S. (2007). Lanthanide and Actinide Chemistry. Chichester: John Wiley & Sons. p. 150. ISBN 978-0-470-01006-8.
↑ Rayner-Canham, G.; Overton, T. (2013). Descriptive Inorganic Chemistry (6ª ed.). Nova York: W. H. Freeman and Company. ISBN 978-1464125577.
↑ Brown, T. L. . E. A.; Brown, T. L.; Woodward, P. . C. A.; Murphy, C. J.; Bursten, B. E.; LeMay, J. H. E. (2009). Chemistry : the central science. - 11th Edition (11ª ed.). Nova Jersey: Pearson Prentice Hall. ISBN 9780136006176.
↑ Moeller; et al. (1989). Chemistry with Inorganic Qualitative Analysis (3ª ed.). San Diego: Harcourt Brace Jovanovich. pp. 955–956, 958. ISBN 0155064924.
↑ Scerri, E. (2015). "Five ideas in chemical education that must die – part five". Education in Chemistry. Royal Society of Chemistry. Arquivado dende o orixinal o 23 de decembro de 2015. Consultado o 19 de setembro de 2015.
↑ Jensen, W. B. (2015). "Some Comments on the Position of Lawrencium in the Periodic Table" (PDF). Arquivado dende o orixinal (PDF) o 23 de decembro de 2015. Consultado o 20 de setembro de 2015.
↑ Xu, W-H.; Pyykkö, P. (2016). "Is the chemistry of lawrencium peculiar?". Physical Chemistry Chemical Physics 18 (26): 17351–17355. Bibcode:2016PCCP...1817351X. doi:10.1039/C6CP02706G.
↑ King, R. B. (1995). Inorganic Chemistry of Main Group Elements. New York: Wiley-VCH. p. 289. ISBN 1-56081-679-1.
↑ "transition element". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
↑ Xuefang, W.; Andrews, L.; Riedel, S.; Kaupp, M. (2007). "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4". Angew. Chem. Int. Ed. 46 (44): 8371–8375. PMID 17899620. doi:10.1002/anie.200703710.
↑ Jensen, W. B. (2008). "Is Mercury Now a Transition Element?". J. Chem. Educ. 85 (9): 1182–1183. Bibcode:2008JChEd..85.1182J. doi:10.1021/ed085p1182.
↑ Rayner-Canham, G.; Overton, T. Descriptive inorganic chemistry (4ª ed.). Nova York: W H Freeman. pp. 484–485. ISBN 0-7167-8963-9.
↑ Schändel, M. (2003). The Chemistry of Superheavy Elements. Dordrecht: Kluwer Academic Publishers. p. 277. ISBN 1-4020-1250-0.
↑ Scerri 2011, pp. 142–143.
↑ Frazier, K. (1978). "Superheavy Elements". Science News 113 (15): 236–238. JSTOR 3963006. doi:10.2307/3963006.
↑ Pyykkö, P. (2011). "A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions". Physical Chemistry Chemical Physics 13 (1): 161–168. Bibcode:2011PCCP...13..161P. PMID 20967377. doi:10.1039/c0cp01575j.
↑ Fricke, B.; Greiner, W.; Waber, J. T. (1971). "The continuation of the periodic table up to Z = 172. The chemistry of superheavy elements". Theoretica chimica acta (Springer-Verlag) 21 (3): 235–260. doi:10.1007/BF01172015.
↑ Elliot, Q. A. (1911). "A modification of the periodic table". Journal of the American Chemical Society 33 (5): 684–688 (688). doi:10.1021/ja02218a004.
↑ Seaborg, G. (c. 2006). "transuranium element (chemical element)". Encyclopædia Britannica. Arquivado dende o orixinal o 30 de novembro de 2010. Consultado o 16 de marzo de 2010.
↑ Cwiok, S.; Heenen, P.-H.; Nazarewicz, W. (2005). "Shape coexistence and triaxiality in the superheavy nuclei". Nature 433 (7027): 705–9. Bibcode:2005Natur.433..705C. PMID 15716943. doi:10.1038/nature03336.
↑ 178,0178,1 Ball, P. (2010). "Would Element 137 Really Spell the End of the Periodic Table? Philip Ball Examines the Evidence". Chemistry World (Royal Society of Chemistry). Arquivado dende o orixinal o 21 de outubro de 2012. Consultado o 30 de setembro de 2012.
↑ Karol, P. J. (2002). "The Mendeleev–Seaborg periodic table: Through Z = 1138 and beyond". Journal of Chemical Education 79 (1): 60–63. doi:10.1021/ed079p60.
↑ Eisberg, R.; Resnick, R. (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles (PDF) (2ª ed.). John Wiley & Sons. ISBN 978-0471873730.
↑ Bjorken, J. D.; Drell, S. D. (1964). Relativistic Quantum Mechanics. McGraw-Hill. ASIN B0000CMCMI.
↑ Greiner, W.; Schramm, S. (2008). "Resource Letter QEDV-1: The QED vacuum". American Journal of Physics 76: 509. doi:10.1119/1.2820395.
↑ Bradley, David (20 de xullo de 2011). "At Last, A Definitive Periodic Table?". ChemistryViews. doi:10.1002/chemv.201000107.
↑ 184,0184,1 Scerri, Eric (9 de agosto de 2013). "Is there an optimal periodic table and other bigger questions in the philosophy of science". ericscerri23.blogspot.com.au. Arquivado dende o orixinal o 13 de xuño de 2017. Consultado o 4 de setembro de 2013.
↑ Scerri 2011, pp. 127-128.
Véxase tamén |
Wikimedia Commons ten máis contidos multimedia na categoría: Táboa periódica dos elementos |
Bibliografía |
Ball, P. (2002). The Ingredients: A Guided Tour of the Elements (en inglés). Oxford University Press. ISBN 0-19-284100-9.
Bermejo, M. R.; González, A.; Vázquez, M. (2006). O nome e o símbolo dos elementos químicos (PDF). Xunta, Secretaría Xeral de Política Lingüística e CRPIH. ISBN 978-84-453-4325-8.
Bermejo, M. R.; González, A.; Maneiro, M. (2018). Guía dos elementos químicos. Historia, propiedades e aplicacións. Xunta de Galicia e CRPIH. ISBN 978-84-453-5297-7.
Chang, R. (2002). Chemistry (en inglés) (7ª ed.). Nova York: McGraw-Hill Higher Education. ISBN 978-0-19-284100-1.
Emsley, J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements (en inglés). Nova York: Oxford University Press. ISBN 978-0-19-960563-7.
Gray, T. (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe (en inglés). Nova York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements (en inglés). Oxford: Pergamon Press. ISBN 0-08-022057-6.
Huheey, J. E.; Keiter, E. A.; Keiter, R. L. (1997). Principles of structure and reactivity (en inglés) (4ª ed.). Nova York: Harper Collins College Publishers. ISBN 0-06-042995-X.
Scerri, E. (2007). The periodic table: Its story and its significance (en inglés). Oxford University Press. ISBN 0-19-530573-6.
Scerri, E. (2011). The periodic table: A very short introduction (en inglés). Oxford University Press. ISBN 978-0-19-958249-5.
Venable, F. P. (1896). The Development of the Periodic Law (en inglés). Easton, Pensilvania: Chemical Publishing Company. OL 7066455M.
Ligazóns externas |
"Periodic Table of Elements". IUPAC (en inglés).
"The periodic table of the elements". WebElements (en inglés).
"The Periodic Table of Videos" (en inglés). Universidade de Nottingham.
"Táboa periódica dos elementos" (PDF). Consello da Cultura Galega, Xunta de Galicia, Real Academia Galega de Ciencias, Real Academia Galega e Ciencia Nosa. 2019.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||
|
Categoría:
- Elementos químicos
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"6.644","walltime":"7.137","ppvisitednodes":"value":221648,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":1120719,"limit":2097152,"templateargumentsize":"value":121581,"limit":2097152,"expansiondepth":"value":15,"limit":40,"expensivefunctioncount":"value":9,"limit":500,"unstrip-depth":"value":1,"limit":20,"unstrip-size":"value":224493,"limit":5000000,"entityaccesscount":"value":10,"limit":400,"timingprofile":["100.00% 6272.551 1 -total"," 51.94% 3258.053 1550 Modelo:Cor_elemento"," 24.10% 1511.425 208 Modelo:Cela_elemento"," 23.65% 1483.198 1 Modelo:Táboa_periódica_grande"," 20.18% 1265.557 118 Modelo:Cela_elemento_con_nome"," 16.96% 1063.981 1 Modelo:Táboa_periódica_(bloques)"," 16.77% 1051.923 2 Modelo:Listaref"," 14.04% 880.410 3 Modelo:Navbox"," 11.70% 733.924 290 Modelo:Cela_elemento_compacta"," 9.70% 608.481 1 Modelo:Grupos_da_táboa_periódica"],"scribunto":"limitreport-timeusage":"value":"2.892","limit":"10.000","limitreport-memusage":"value":5512420,"limit":52428800,"cachereport":"origin":"mw1309","timestamp":"20190428102152","ttl":2592000,"transientcontent":false);mw.config.set("wgBackendResponseTime":147,"wgHostname":"mw1238"););