Alcohol Índice Historia | Metanol e etanol | Química orgánica | Procesos químicos | Fontes | Propiedades xerais | Usos | Alcohol de caixa de urxencias | Notas | Véxase tamén | Menú de navegaciónDicionario da Real Academia GalegaPortal das PalabrasDicionario da Real Academia GalegaPortal das PalabrasCompendium of Chemical Terminologye2055424782301810824141899-2alcoholssh8500331400560350601230879D000438
Substancias químicasCompostos químicosGrupos funcionais
árabeetanolbebida alcohólicagrupo hidroxilosaturadofenoisdeterminanteséculo XIVmédicoArnau de VillanovaalquimistaMontpellierRamon LlullAntoine Lavoisierfermentoácido carbónicoScheeleGehleThénardBoullay1854Berthelotmetanoletanolfórmula xerallíquidossolublesdensosalcanosligazóns de hidróxenoalquílicadipologrupo alcoxiimpedimento estéricoefecto indutivocarbono terciariocarbono secundariocarbono primariosolvateácido clorhídricoácido de Lewiscloruro de zinccloruro de tioniloácido bromhídricotribromuro de fósforofósforo vermelloiodotriioduro de fósforoácido mineralácido sulfúricoreacción de Appelfermentaciónfroitasgranslévedocombustiblebebidagas naturalpetróleolíquidosincolorossolublesdensossólidosalcohol etílicobebida alcohólicadisolventescombustiblesetanolmetanolgasolinagasóleoperfumesvainillasíntese orgánicaalcohol etílicocloruro de benzalconioAcetiloAcetoxiAcroloílAciloAlcoholAldehidoAlcanoAlquenoAlquinoAlcoxiAmidaAminaAzoBencenoCarbenoCarboniloCarboxiloCetonaCianatoDisulfuroÉsterÉterEpóxidoHaloalcanoHidrazonaHidroxiloImidaIminaIsocianatoIsonitriloIsotiocianatoMetiloMetilenoMetinoNitriloNitroNitrosoOrganofosforadoOximaPeróxidoFosfonosoFosfónico (ácido)PiridinaSulfonaSulfónico (ácido)SulfóxidoTiocianatoTioésterTioéterTiolUrea
Alcohol
Saltar ata a navegación
Saltar á procura

Modelo do grupo funcional hidroxilo (-OH) nunha molécula de alcohol. Os tres R representan carbonos substituíntes ou átomos de hidróxeno.

Fórmula esqueletal.
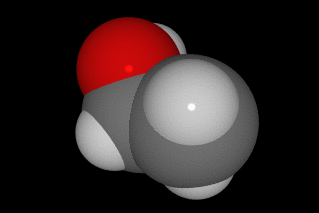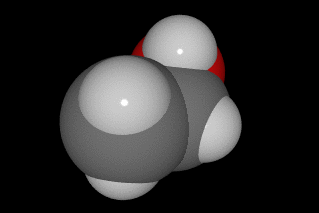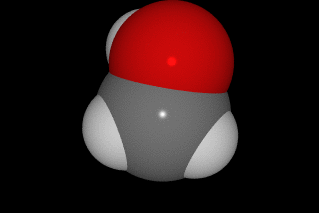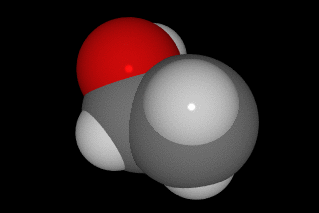
oxíxeno vermello, carbono gris e hidróxeno branco.
O alcohol[1] ou alcol[2] (do árabe al-khwl الكحول, ou al-ghawl الغول, ‘o espírito’, ‘toda substancia pulverizada’, ‘líquido destilado’) refírese case sempre ao etanol, e por extensión a calquera bebida que conteña etanol (bebida alcohólica). En química, alcohol é un termo máis xeral, aplicado a calquera compoñente orgánico no cal un dos carbóns está ligado a un grupo hidroxilo (-OH) substituíndo a un átomo de hidróxeno. A fórmula xeral é CnH2n+1OH. Ademais este carbono debe estar saturado, é dicir, debe ter só ligazóns simples a sendos átomos;[3]
isto diferenza ós alcohois dos fenois.
Se conteñen varios grupos hidroxilos denomínanse polialcois. Os alcois poden ser primarios, secundarios ou terciarios, en función do número de átomos de hidróxeno substituídos no átomo de carbono ó que se atopa ligado o grupo hidroxilo.
Índice
1 Historia
2 Metanol e etanol
3 Química orgánica
3.1 Nomenclatura
3.2 Formulación
3.3 Propiedades xerais
3.4 Propiedades químicas dos alcois
4 Procesos químicos
4.1 Haloxenación de alcois
4.2 Oxidación de alcois
4.3 Deshidratación de alcois
5 Fontes
6 Propiedades xerais
7 Usos
8 Alcohol de caixa de urxencias
9 Notas
10 Véxase tamén
10.1 Outros artigos
Historia |
A palabra alcohol provén do árabe الكحول al-kukhūl 'o espírito', de al- (determinante) e kuḥūl que significa 'sutil'. Isto débese a que antigamente chamábase "espírito" ós alcois. Por exemplo "espírito de viño" ó etanol, e "espírito de madeira" ó metanol.
Os árabes coñeceron o alcohol extraído do viño por destilación. Con todo, o seu descubrimento remóntase a principios do século XIV, atribuíndose ó médico Arnau de Villanova, sabio alquimista e profesor de medicina en Montpellier. A quinta esencia de Ramon Llull non era outra cousa que o alcohol rectificado a unha temperatura máis suave. Antoine Lavoisier foi quen deu a coñecer a orixe e a maneira de producir o alcohol por medio da fermentación vínica, demostrando que baixo a influencia do fermento de cervexa o azucre de uva transfórmase en ácido carbónico e alcohol. Foi ademais estudado por Scheele, Gehle, Thénard, Duma e Boullay e en 1854 Berthelot obtívoo por síntese.[4]
Metanol e etanol |
Os alcohois máis simples e máis comunmente usados son o metanol e o etanol, que teñen as seguintes estruturas:
H H H
| | |
H-C-O-H H-C-C-O-H
| | |
H H H
metanol etanol
Química orgánica |
Nomenclatura |
- Común (non sistemática): antepoñendo a palabra alcohol e substituíndo o sufixo -ano do correspondente alcano por -ílico. Así por exemplo teríamos alcohol metílico, alcohol etílico, alcohol propílico, etc.
IUPAC: engadindo unha l (ele) ó sufijo -ano no nome do hidrocarburo precursor (met-ano-l, de onde met- indica un átomo de carbono, -ano- indica que é un hidrocarburo alcano e -l que se trata dun alcohol), e identificando a posición do átomo do carbono ó que se atopa enlazado o grupo hidroxilo (3-butanol, por exemplo).- Cando o grupo alcohol é substituínte, emprégase o prefixo hidroxi-
- Utilízanse os sufixos -diol, -triol, etc., segundo a cantidade de grupos OH que se atope.
Formulación |
Os monoalcois derivados dos alcanos responden á fórmula xeral CnH2n+1OH.
Propiedades xerais |
Os alcois adoitan ser líquidos incoloros de cheiro característico, solubles na auga en proporción variable e menos densos que ela. Ó aumentar a masa molecular, aumentan os seus puntos de fusión e ebulición, podendo ser sólidos a temperatura ambiente (p.e. o pentaerititrol funde a 260 °C). A diferenza dos alcanos dos que derivan, o grupo funcional hidroxilo permite que a molécula sexa soluble en auga debido á similitude do grupo hidroxilo coa molécula de auga e permítelle formar ligazóns de hidróxeno. A solubilidade da molécula depende do tamaño e forma da cadea alquílica, xa que a medida que a cadea alquílica é máis longa e máis voluminosa, a molécula tenderá a parecerse máis a un hidrocarburo e menos á molécula de auga, polo que a súa solubilidade será maior en disolventes apolares, e menor en disolventes polares. Algúns alcois (principalmente polihidroxílicos e con aneis aromáticos) teñen unha densidade maior que a da auga.
O feito de que o grupo hidroxilo poida formar ligazóns de hidróxeno tamén afecta ós puntos de fusión e ebulición dos alcois. A pesar de que a ligazón de hidróxeno que se forma sexa moi débil en comparación con outros tipos de ligazóns, fórmanse en gran número entre as moléculas, configurando unha rede colectiva que dificulta que as moléculas poidan escapar do estado no que se atopen (sólido ou líquido), aumentando así os seus puntos de fusión e ebulición en comparación cos alcanos correspondentes. Ademais, ambos os puntos adoitan estar moi separados, polo que se empregan frecuentemente como compoñentes de mesturas anticonxelantes. Por exemplo, o 1,2-etanodiol ten un punto de fusión de -16 °C e un punto de ebulición de 197 °C.
Propiedades químicas dos alcois |
Os alcois poden comportarse como acedos ou bases grazas a que o grupo funcional é similar á auga, polo que se establece un dipolo moi parecido ó que presenta a molécula de auga.

Por unha banda, se se enfronta un alcohol cunha base forte ou cun hidruro de metal alcalino fórmase o grupo alcoxi, onde o grupo hidroxilo se desprotona deixando ó osíxeno con carga negativa. A acidez do grupo hidroxilo é similar á da auga, aínda que depende fundamentalmente do impedimento estérico e do efecto indutivo. Se un hidroxilo se atopa enlazado a un carbono terciario, este será menos acedo que se se atopase enlazado a un carbono secundario, e á súa vez este sería menos acedo que se estivese enlazado a un carbono primario, xa que o impedimento estérico impide que a molécula se solvate de maneira efectiva. O efecto indutivo aumenta a acidez do alcohol se a molécula posúe un gran número de átomos electronegativos unidos a carbonos adxacentes (os átomos electronegativos axudan a estabilizar a carga negativa do osíxeno por atracción electrostática).
Doutra banda, o osíxeno posúe 2 pares electrónicos non compartidos polo que o hidroxilo podería protonarse, aínda que na práctica isto conduce a unha base moi débil, polo que para que este proceso ocorra, é necesario enfrontar ó alcohol cun ácido moi forte.
Procesos químicos |
Haloxenación de alcois |
Para fluorar calquera alcohol requírese do reactivo de Olah.
Para clorar ou bromar alcois, débense tomar en conta as seguintes consideracións:
- Alcohol primario: os alcois primarios reaccionan moi lentamente. Como non poden formar carbocatións, o alcohol primario activado permanece en solución ata que é atacado polo ion cloruro. Cun alcohol primario, a reacción pode levar desde trinta minutos até varios días.
Alcohol secundario: os alcois secundarios tardan menos tempo, entre 5 e 20 minutos, porque os carbocatións secundarias son menos estables que os terciarios.- Alcohol terciario: os alcois terciarios reaccionan case instantaneamente, porque forman carbocatións terciarios relativamente estables.
Os alcois terciarios reaccionan con ácido clorhídrico directamente para producir o cloroalcano terciario, pero se se usa un alcohol primario ou secundario é necesaria a presenza dun ácido de Lewis, un "activador", como o cloruro de zinc. Como alternativa, a conversión pode ser levada a cabo directamente usando cloruro de tionilo (SOCl2). Un alcohol pode tamén ser convertido a bromoalcano usando ácido bromhídrico ou tribromuro de fósforo (PBr3), ou a iodoalcano usando fósforo vermello e iodo para xerar "in situ" o triioduro de fósforo. Dous exemplos:
- (H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
- CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
Oxidación de alcois |
Metanol: Existen diversos métodos para oxidar metanol a formaldehido e/ou ácido fórmico, como a reacción de Adkins-Peterson.
Alcohol primario: utilízase a piridina (Py) para deter a reacción no aldehido Cr03/H+ denomínase reactivo de Jones, e obtense un ácido carboxílico.
Alcohol secundario: os alcois secundarios tardan menos tempo, entre 5 e 10 minutos, porque os carbocationes secundarios son menos estables que os terciarios.
Alcohol terciario: aínda que se resisten a ser oxidados con oxidantes suaves, se se utiliza un enérxico como o é o permanganato de potasio, os alcois terciarios oxídanse dando como produtos unha cetona cun número menos de átomos de carbono, e libérase metano.
Deshidratación de alcois |
A deshidratación de alcois é un proceso químico que consiste na transformación dun alcohol para poder ser un alqueno por procesos de eliminación. Para realizar este procedemento utilízase un ácido mineral para extraer o grupo hidroxilo (OH) desde o alcohol, xerando unha carga positiva no carbono do cal foi extraído o hidroxilo o cal ten unha interacción eléctrica cos electróns máis próximos (por defecto, electróns dun hidróxeno no caso de non ter outro substituínte) que forman unha dobre ligazón no seu lugar.
Por isto, a deshidratación de alcois é útil, posto que facilmente converte a un alcohol nun alqueno.
Un exemplo simple é a síntese do ciclohexeno por deshidratación do ciclohexanol. Pódese ver a acción do ácido (H2SO4) ácido sulfúrico o cal quita o grupo hidroxilo do alcohol, xerando a dobre ligazón e auga.
Substitúese o grupo hidroxilo por un halóxeno na reacción de Appel.
Fontes |
Moitos alcohois poden ser creados por fermentación de froitas ou grans con lévedo, pero soamente o etanol é producido comercialmente deste xeito, principalmente como combustible e como bebida. Outros alcohois son xeralmente producidos como derivados sintéticos do gas natural ou do petróleo.
Propiedades xerais |
Os alcohois poden ser primarios, secundarios ou terciarios, en función do número de átomos de hidróxeno substituídos no átomo de carbono ao que se atopa enlazado o grupo hidroxilo. Os alcohois primarios e secundarios son líquidos incoloros e de cheiro agradable, solubles na auga en calquera proporción e menos densos ca ela. Os terciarios en cambio son todos sólidos.
Na linguaxe común adoita utilizarse a palabra alcohol como sinónimo de alcohol etílico ou bebida alcohólica.
Usos |
Os alcois teñen unha gran gama de usos na industria e na ciencia como disolventes e combustibles. O etanol e o metanol poden facerse combustionar dunha maneira máis limpa que a gasolina ou o gasóleo. Pola súa baixa toxicidade e dispoñibilidade para disolver substancias non polares, o etanol é utilizado frecuentemente como disolvente en fármacos, perfumes e en esencias vitais como a vainilla. Os alcois serven frecuentemente como versátiles intermediarios na síntese orgánica.
Alcohol de caixa de urxencias |
O alcohol da caixa de urxencias pode ter varias composicións. Pode ser totalmente alcohol etílico ó 96º, con algún aditivo como o cloruro de benzalconio ou algunha substancia para darlle un sabor desagradable. É o que se coñece como alcohol etílico desnaturalizado. Tamén se utilizan como desnaturalizantes o ftalato de dietilo e o metanol, o cal fai tóxicos a algúns alcois desnaturalizados.
Notas |
↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para alcohol.
↑ Definicións no Dicionario da Real Academia Galega e no Portal das Palabras para alcol.
↑ Unión Internacional de Química Pura e Aplicada. Compendium of Chemical Terminology. (en inglés)
↑ Dicionario enciclopédico popular ilustrado Salvat (1906-1914)
Véxase tamén |
Wikimedia Commons ten máis contidos multimedia na categoría: Alcohol |
Outros artigos |
- Alcoholismo
- Ácido graxo
- Éster
- Droga
| ||||||||||
|
|
Categorías:
- Substancias químicas
- Compostos químicos
- Grupos funcionais
(RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.424","walltime":"0.668","ppvisitednodes":"value":853,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":31349,"limit":2097152,"templateargumentsize":"value":2024,"limit":2097152,"expansiondepth":"value":11,"limit":40,"expensivefunctioncount":"value":10,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":2522,"limit":5000000,"entityaccesscount":"value":11,"limit":400,"timingprofile":["100.00% 590.533 1 -total"," 51.93% 306.666 1 Modelo:Control_de_autoridades"," 13.70% 80.906 1 Modelo:Listaref"," 11.35% 67.037 1 Modelo:Commonscat"," 11.16% 65.918 1 Modelo:Cita_libro"," 10.54% 62.238 1 Modelo:Irmáns"," 9.86% 58.249 1 Modelo:Caixa_lateral"," 7.05% 41.660 1 Modelo:1000_artigos_icona_título"," 5.66% 33.440 1 Modelo:Grupos_funcionais"," 4.68% 27.646 1 Modelo:Navbox"],"scribunto":"limitreport-timeusage":"value":"0.223","limit":"10.000","limitreport-memusage":"value":4805555,"limit":52428800,"cachereport":"origin":"mw1300","timestamp":"20190607062555","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"Alcohol","url":"https://gl.wikipedia.org/wiki/Alcohol","sameAs":"http://www.wikidata.org/entity/Q156","mainEntity":"http://www.wikidata.org/entity/Q156","author":"@type":"Organization","name":"Contribuidores dos projetos da Wikimedia","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2004-01-29T12:11:39Z","dateModified":"2018-12-27T20:45:25Z","image":"https://upload.wikimedia.org/wikipedia/commons/0/02/Alcohol.png","headline":"compou00f1ente orgu00e1nico no cal un dos carbu00f3ns estu00e1 ligado a unu00a0grupo hidroxilo substituu00edndo a un u00e1tomo de hidru00f3xeno"(RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":195,"wgHostname":"mw1329"););